美国食品药品管理局(FDA)及相关的国际组织, 致力于制定长期法规服务大众,确保药品的效力、 一致性和纯度。当前《优良操作规范(current Good Manufacturing Practices,cGMPs)》中的法规条例要求生产商按照详细的过程和规范, 来确保产品质量和安全1。
长久以来,医药行业设计清洁验证程序时,都围绕来源于HPLC数据的主观的限值和不切实际的回收 率测试。实际上,很多淋洗样品都只是达到药典对于产品放行的规定,而非设备放行规定。
这篇应用文章旨在启发读者,重新思考目前清洁验证中使用的分析方法,并质疑是否在合适的应用中 使用了合适的方法。
当前阶段
过去的几十年,其他行业已开始陆续使用因技术发展而产生的过程质控战略,事实证明其更GX,更 有效。但是医药行业却因为各种原因对于这一改进战略的采纳过于缓慢,其中,过程分析技术(PAT) 的监管不确定性就是原因之一。另外,之前对于清洁过程验证的检查指南(1993)被USFDA以外的监察机构,指导性机构(ICH,PIC/s)所广泛采用, 用于指导客户使用一个简单框架或生命周期法来进行清洁过程的验证。
然而,Z近业内和监管者同时注意到,使用TOC方法能实现质量的提升和成本的控制,很多制药企业 开始采用非专属性方法进行实时放行,以及清洁过 程控制和生产设备放行。指导文件,如FDA PAT文 档所描述的,及FDA 2011年《过程验证指南》,提 供了如何使用非专属性方法,以符合cGMP关键的 中清洁应用的框架。过程验证指南文档对过程验证 生命周期方法的定义如下:2.3
期望阶段
总有机碳(TOC)是一种关键质量属性(CQA, Critical Quality Attribute),是检测清洁的关键过 程参数(CPP,Critical Process Parameters)的 众多手段之一。依靠定期实验室淋洗或棉签取样的 专属性方法(例如HPLC),与使用已确认、经方法验证并在清洁验证生命周期的各关键步骤使用 TOC仪相比较,前者相对效率低且不可靠。
但是,这种TOC的应用只能与清洁相关的过程验证 生命周期方法配合使用。在这一应用中每个阶段都 可能影响TOC值。例如,用户需要了解潜在的使用 TOC时所需的各种因素,及其对分析方法产生的影响。
未来阶段
要注意到,大部分的药典方法都不是专门为确认持 续过程的分析仪,而预定或设计的。法规的指南建 议用户可考虑将TOC方法作为清洁验证或确认的测 试方法的一种“可替代的分析方法”。1 简单来说, 用户有责任通过规定的方法与工艺验证过程,对其预定的用途,建立分析仪的适用性。
除了为清洁过程验证所使用的方法建立系统适用性, 在清洁验证生命周期中还有其他重要步骤需要考虑, 以确保TOC符合cGMP、质量专章与行业指导文件。
步骤如下:
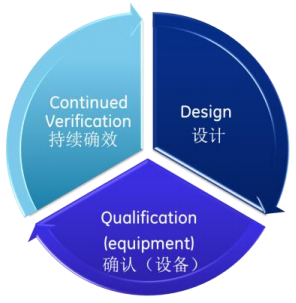
设计
• 生产设备的目标用途
• 清洁剂和Z差情况的化合物
• 对生产设备的 TOC 取样(棉签或淋洗法)
• 回收率百分比研究
• 验收限值或标准(风险评估和工艺产能)
• 分析仪器确认(USP<1058>)
• 其他验证方法(ICH Q2r1)
确认(生产设备)
• 生产设备的TOC取样(棉签或淋洗法)
持续确效
• 生产设备的TOC取样(棉签或淋洗法)
采取行动
如之前所述,越来越多的公司正在使用TOC分析进 行清洁验证,因为它更快、更简便,而且比其他分 析方法更经济。TOC方法的样品检测量大,并减少了清洁验证协议实施的时间。即便在生物制药行业 经常遇到的化合物难溶于水,或者含大量蛋白质情 况下,也依旧有效,尽管如果清洁过程的设计是有效的话,这些化合物不应该存在。另外,FDA在检测污染物残留的规章指南中,已经接受了TOC方法。
很简单地就可以断定,在清洁验证的生命周期中, 多种化合物必然需要多种分析测试。在多种测试中, 某些意料之外的杂质或清洁剂可能会被忽略,又或者在色谱法分析中出现未知峰。TOC能测出多种目 标化合物,因为它是一种非专属性方法。然而,遵 循以下步骤,以确保成功的转换及正确应用的实施 还是非常重要的:
分析仪器的确认
分析仪器确认是一个过程,确保对特定测试使用分析方法是能符合目标用途的。根据cGMP规定,“企 业所使用的检测方法的准确度,灵敏度(检测限), 专属性和重现性(精确度)必须确立并有文件证 明。”2在这种情况下用TOC法进行清洁过程验证的测试之前,对分析仪器进行严格的确认就尤为重要。 此方法包括由USP<1058>所建议的安装确认、运行确认和性能确认(IQ/OQ/PQ)。
方法和过程验证
清洁验证的TOC实施方案通常由四个关键部分组成, 以确保有效、GX地转换为用TOC分析进行清洁过程验证。
• 回收率(可行性)测试
回收率测试或者可行性测试常被作为建议方法,以确定分析物是否适用TOC方法。通常,这种研究只要确定在工艺物料流中,哪种化合物是Z难从设备表面清除的。这一研究的目的是为了论证,设备表面或水溶液中,目标化合物的回收率。研究应该在可控条件下的实验室进行,但应尽可能反映制药生 产中清洁过程的真实情况。
• 方法验证和取样灵敏度测定模板
规定指出,制药或生物制药企业必须有文件记录的 程序,包含一系列额外进行的对清洁过程方法验证 的测试。这些协议用于证明一个系统或过程(常见 或特殊的),能在可靠的方式及控制中实现其目标用途,生产出的产品能持续满足之前确定的规格。 这些规范采用了ICH Q2r1中提及的验证特性,包括 线性、准确度和精确度。此外,基于直接与间接取 样技术确定灵敏度,是Z好的操作。3
• 设备性能确认
通常,所有制药处理设备、管路、连接器、玻璃器 皿和备件的自动或手动清洗顺序,都按照同样的工 艺流程,即在Z后的淋洗步骤时采样,并使用经验 证的分析方法进行分析。这个步骤通常会包括TOC、 电导率、内毒素、微生物限度和pH。其他用于设备性能确认的分析包括产品专属性试验。然而,TOC 仅仅是确认生产设备的众多工具之一。4.5
• 持续确效(日常监控或产品切换)
TOC仅仅是清洁过程的验证状态或产品切换时的日常监控的多种手段之一。也有其他独特的方法,在 实验室以外,收集样品,分析TOC,并报告结果或通过/失败标准。若把TOC方法从实验室转换至生产区域,能实时“在使用点“检测,这将是一个有效果且有效率的途径。但是在转换前,必须建立并执行比较性协议。1
参考文献
1.FDA网站: www.fda.gov/cder/guidance/cGMPs/equipmen t.htm#TOC
2. “黄金表格(The Gold Sheet).” FDC 报告, March 2005
3. FDA 网站: www.accessdata.fda.gov/scripts/wlcfm/indexd ate.cfm
4. FDA指导文档:制药质量控制实验室检查指南 (Guide to Inspection of Pharmaceutical Quality Control Laboratories)
5. 假设生产设备的日常维护时停产(This assumes a production shut down for routine maintenance on manufacturing equipment.)
6. Andrew W. Walsh
7. USP <643>总有机碳(Total Organic Carbon)
近年来组织透明化方法发展得如火如荼,目前组织透明化方法有油性,基于水凝胶和水性的组织透明化方法。其中油性组织
沈兴志珠海欧美克仪器有限公司产品经理,主要负责粒度检测技术产品的应用和技术支持工作。对于粒度粒形表征基础理论
大气腐蚀&促进腐蚀的环境因素腐蚀的定义欧洲卷材涂料协会给出腐蚀的定义:使物质达到其自然的,zui低能
压敏胶粘带是特殊类型的胶带,将一种特殊胶粘剂(压敏胶)涂于带状基材上制成。由压敏胶、基材、底胶、背面处理剂等
近年来USP和ICH都针对分析方法开发与验证进行了修订。USP新收录通则<1220>分析方法生命
动态光散射 (DLS) 正在成为制药行业中越来越流行的亚微米级药品粒度分析技术。本技术说明试图为使用此技术进行方
方法的证实在引入检测或校准之前,实验室应证实能够正确地运用这些标准方法。如果标准方法发生了变化,应重新进行证
现在做无人机的控制方法,主要是无人机的姿态测量设备精度不高,请问针对这种情况该采用什么控制方法啊,就是要求
叮铃铃~安谱实验的干货分享时间到咯小板凳已备好,抓紧时间进来啦
水质监测珍惜水资源,保护水环境。水质监测是保护水资源的基本手段之一,是水资源保护科学研究的基础,对水污染控制