2019年9月24日,清华大学李蓬课题组在Cell Reports上发表了题为“The protein phosphatase 1 complex is a direct target of AKT linking insulin signaling to hepatic glycogen deposition”的研究论文,报道了PP1复合物作为营养感知器,独立于GSK3介导胰岛素刺激下肝脏糖原合成的调节机制。
胰岛素是机体调节血糖吸收、促进合成代谢(anabolic metabolism)Z关键的激素,可以促进糖原、脂肪、蛋白质合成。糖原和脂肪可被用于能量贮存;糖原是Z先被机体利用的能量储备:比如在运动时,肌肉糖原可以作为快速的能量来源,供肌肉细胞产生ATP;而肝脏中糖原负责在饥饿或能量缺乏时补充血糖,使之维持稳定浓度。但是糖原代谢里一个长期悬而未决的问题,胰岛素是如何激活糖原合成的?甚至在Z新版(第七版)的Lehninger生化教科书中,也只是指出需要一个“insulin-sensitive protein kinase”,但不知其身份。虽然胰岛素-AKT可以通过YZ激酶GSK3、降低糖原合成酶GS磷酸化来促进糖原合成,但是这条调节通路的作用非常有限,因为GSK3的磷酸化位点突变后不影响糖原合成。并且,GSK3调控糖原合成是通过双YZ作用而起作用,目前我们的认识里还缺乏一种主动糖原合成调控的机制。虽然已知胰岛素还通过激活磷酸酶PP1,进而调节多个关键糖原代谢酶,然而由于对phosphatase调节研究的困难,领域内只能猜测却难以发现这个调节PP1磷酸酶的“insulin-sensitive protein kinase”。
PP1(protein phosphatase1)对糖代谢具有重要作用,参与调节多个糖原代谢酶活性,包括GS、GP和GPK。PP1全酶由一个催化亚基(PP1c)和一个调节亚基(PPP1R)组成。已知PPP1R3家族作为特殊的一类调节亚基可以把PP1靶向到糖原代谢过程,该家族包括7个成员,PPP1R3a-g。尽管一些研究表明PPP1R3成员参与调节肝脏糖原合成和积累,但是具体的机制究竟是如何呢?
针对这个问题,李蓬团队首先通过生物信息学分析磷酸化蛋白组数据库数据,找到了10个候选蛋白,可能是AKT新的磷酸化底物,同时也参与调节糖脂代谢。随后通过生化实验鉴定出PPP1R3g是AKT一个新的直接底物,同时结合质谱分析发现S79是PPP1R3g的AKT磷酸化位点。其后,课题组发现在胰岛素刺激下PPP1R3g可以直接被AKT磷酸化,更重要的是发现生理和病理条件下的胰岛素信号与PPP1R3g磷酸化水平密切相关。更进一步地,课题组发现在胰岛素刺激下,PPP1R3g介导糖原合成是不依赖于经典的GSK3途径的。接下来,课题组通过敲除和过表达系统在体研究了PPP1R3g磷酸化的生理功能,发现PPP1R3g磷酸化可以加快葡萄糖清除和提高胰岛素敏感性。在机制上,课题组发现PPP1R3g磷酸化可以提升与p-GS的结合,进而加快PP1c对GS的去磷酸化。同时发现了PPP1R3b可作为PPP1R3g的下游,通过结合从PPP1R3g上解离下来的去磷酸化GS,刺激糖原的合成,从而实现对胰岛素信号的传递。
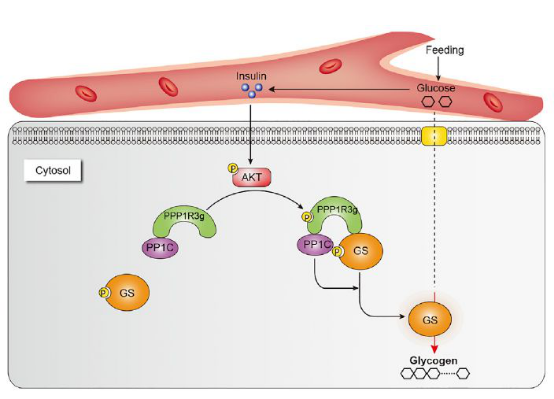
图1. 胰岛素-AKT调控PPP1R3G磷酸化促进糖原合成的新机制
本研究回答了本领域近30年一直未回答的问题,为新版的生物化学书籍完善提供重要的一笔(图2)。

图2. 经典生化教科书中可修改的一笔。左图为Lehninger Principles of Biochemistry(7th Edition)中提出的位置激酶,右图则是该研究提供的改写
该论文中,糖原合成酶和糖原磷酸化酶活性的研究均采用放射性方法,利用放射性标记的葡萄糖作为底物,通过检测放射性活度来计算酶的活性。珀金埃尔默提供了从试剂、耗材到检测仪器的完整解决方案,助力ZG科学家取得更大成就。
谁知道清华大学的邮政编码是多少..? 100084 北京市海淀区清华大学 学校介绍 清华大学
2016年3月1日,Quantum量子科学仪器贸易(北京)有限公司与清华大学化工系杨睿教授课题组达成合作意向
近期,我们于清华大学交付使用了超精 准全开放强磁场低温光学研究平台-OptiCool,该设备是发布以来国内的首
中新网北京5月6日电 近日,清华大学地球系统科学系张强教授课题组与环境学院贺克斌院士课
清华大学深圳国际研究生院材料与器件检测技术中心作为深圳市规模较大的高校共享实验平台,依托平台先进的设备优势、
“贝巡检,倍安心”“小贝巡检和应用研讨”活动,通过服务巡检以及技术应用交流研讨,帮助用户更高效使用设备、提升
我这有现场总线的课件,但不知道是不是你想要的那一版,先发给你吧。
利用基因工程技术可使大肠杆菌生产人的胰岛素.下列相关叙述,正确的是( ) A.人和大肠杆菌在合成胰岛素
2013年1月28日因酮症求医确诊糖尿病。后做C肽确诊1型。之后医生让注射胰岛素。一直用的8毫米针头。(本