自 2003 年美国食品与药品管理局出台了联邦法规第 21 章第 11 款(FDA 21 CFR Part 11),对电子数据的真实性、完整性和可靠性,以及电子签名有效性,收集和分析数据的软件必须是经过验证的首次提出了要求。

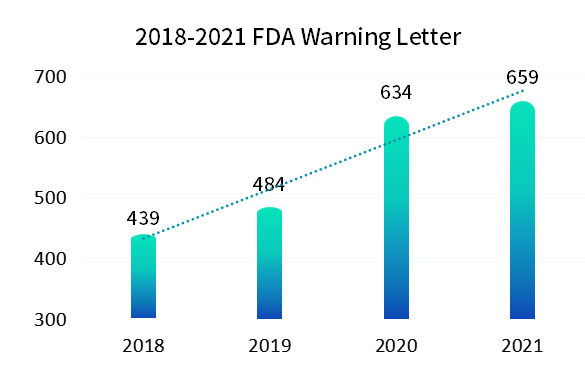
与纸质记录相比,电子记录是动态记录必然会暴露出更多的不合规操作, 2015 年警告信 FDA 483 表格和现场观察报告频频出现,全 球各地监管机构再次更新和完善了一轮法规要求。新法规施行后(2018 版 FDA 21CFR Part11),我们看到如下图统计,最 近几年 FDA 发出的警告信也呈现出逐年上升趋势。作为合规软件的供应厂商,我们也明显感受到国内客户对于合规的要求也是越来越高。
每年年底/年初,制药公司、生物技术公司、CRO、CDMO 等都会进行合规的企业内部审计或国家审计局委派当地审计局进行审计。今年接到多次电话咨询,无论内审还是外审都提到了操作员登录软件是否会被记录到审计追踪中。从审计关注点我们可以看出,国内对审计追踪记录完整性要求在提高,审计追踪不仅仅记录修改,还要记录登录/登出和查看信息;这也从侧面反映法规对数据的隐私性越来越重视了。
Molecular Devices 公司 SoftMax Pro 7.1.2 GxP 软件除了能够记录完整的审计追踪,还能够记录数据文件的生命周期,实现对数据来源和去向的全流程管理,真正做到无纸化、全流程电子记录和电子签名,最 大限度保证数据记录的真实性、完整性和可靠性。
为什么 我们要对数据进行全流程管理?
因为 2020 年 12 月 1 日正式施行的国家药品监督管理局发布的药品记录与数据管理要求(试行)第二章基本要求中有如下要求,

针对这项最 新要求 SoftMax Pro 7.1.2 GxP 软件新增了数据文件状态显示(如下图),在数据库中和打开数据时都会显示当前文件所处的生命周期状态。

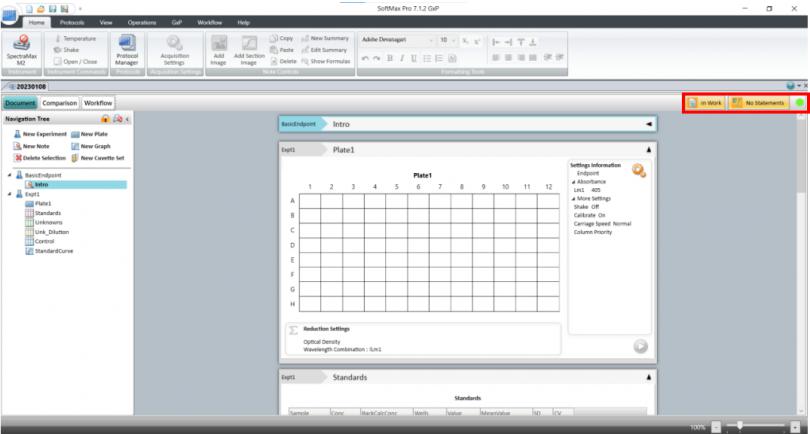
如 Scientist 权限新建数据状态是 in work 表示正在进行模板方法开发,经过 Lab Manager 层层审批并电子签名后可以更改文件状态并将开发好的模板 release 出来,这时 Lab Technician 才有权限打开模板进行读板和数据分析,签名后数据将被锁定不可更改,Lab Manager 审核后电子签名 Approved。如果发现数据有问题,可以 canceled;如果因为改进流程更新方法模板,可以将更改旧模板状态成 outdated,并不赋予 Lab Technician 打开 outdated 权限,以免使用错误模板读板产生不合规的数据。
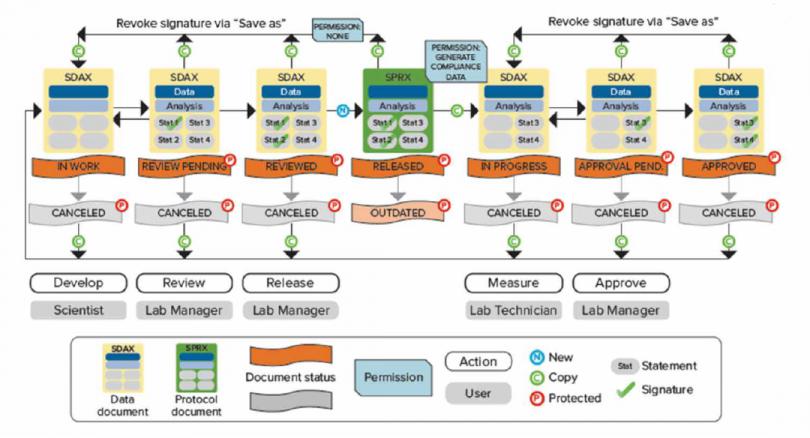
数据文件存储在 SQL Server 数据库中,文件的导入、重命名、移动、删除、归档等都会记录在审计追踪中,真正做到了从数据来源到最 终归档全流程管控。
实验室数据完整性合规利器数据完整性和可靠性是受法规监管行业持续关注的重 点,而随着工业化和信息化水平的不断提高
误区一:仪器日志就是审计追踪?错!对于某些系统,仪器日志可以认为是审计追踪系统的一部分,但并不等同于审计追踪
摘 要BACT/ALERT3D DUAL-T是一款全自动化、基于微生物生长产CO2呼吸作用、具有双温度培养控制的
在受法规监管的制药行业中,分析测试过程中数据的完整性和可靠性对于需要遵守
近日如火如荼的ISO审计又要开始啦。兢兢业业审计每一个细节,严肃又稳妥,细致又缜密。我们皓天全体员工积极配合
有毒或有害物质的迁移,影响着药品包装、食品接触性材料以及医疗器械材料的潜在化学安全性。材料生产和终端应用商需
背景介绍不同系统的审计追踪记录对药品生产过程中的质量控制和合规性提出严峻挑战。因此,拥有全面的化学分析记录对
根据WHO TRS 1033 Annex 4 Guideline on data integrity(2021)规定,数据和
硬件技术日新月异,软件也要跟上步伐,才能加速实验室高效合规运行。冬之时万物终成,也该忙碌明年的计划了。实验室
可不可以理解吧光栅化渲染出的图片比喻成数码相机拍出来的图片放大之后是一个一个的像素点,而光线追踪算法渲染出