- 2022-07-05 15:18:58 来源:大昌洋行(上海)有限公司(大昌华嘉科学仪器部) 浏览量:233次
- 【导读】单克隆抗体(mab)和赋形剂在人体内由于其货架期或给药后遇到不同的应力而发生降解。 这可能导致聚集物和微粒的形成。
-

摘要
单克隆抗体(mab)和赋形剂在人体内由于其货架期或给药后遇到不同的应力而发生降解。 这可能导致聚集物和微粒的形成。 由于颗粒可以引起患者的免疫反应,因此在给药后监测他们的状态变得越来越重要。 在本研究中,我们使用无蛋白血清模型来评估单抗和聚山梨酯(PS)颗粒在生理条件下的状态。 通常遇到的应力条件,如pH值、温度、挤压和振动被选择来产生mAb颗粒。 采用碱性水解法制备PS颗粒。 在血清和组氨酸缓冲液中评估聚集物和颗粒的状态。 我们观察到,根据应力的性质和粒子所受的环境,颗粒状态可以有本质上的不同。pH胁迫产生的mAb聚集,在14天的人血清滤液中显示HMWS从26%下降到6%。 在37°C时PS颗粒溶解,在5°C时组氨酸颗粒保持不变。 我们的研究结果进一步强调了跟踪药物开发过程中产生的颗粒在生理条件下的状态的必要性。
介绍
单克隆抗体(mab)在生产(例如,纯化)、储存、运输,甚至在临床处理过程中都会受到各种应力。 此外,治 疗性蛋白(TPs)一旦给药后可能会降解,并在生理条件下形成蛋白质聚集物和颗粒(可见和不可见)。 蛋白质聚集物已被证明可以改变药物疗 效,增强免疫原性,并可导致危及生命的后果,如肾衰竭、过敏性休克或纯红细胞发育不全。 因此,这些降解物被认为是一种必需的临界质量属性。 美国药典要求小于100ml的TP制剂中≥10 μm/容器的颗粒不能超过6000个,≥25 μm/容器的颗粒不能超过600个(USP < 788 >)。 然而,对于评估< 10 μm的sbvp的重要性有一个普遍的共识,因为它们会对患者产生相同的影响。
虽然已知TP(如单克隆抗体)可以在体内降解,但关于TP配方(即蛋白和辅料)在给药后的状态,在其物理稳定性方面的知识相当有限。 近年来,体外模型成为临床研究之前评估体内蛋白质稳定性的有价值的工具。Kinderman等人发现胶体稳定性差的单抗在生理条件下会沉淀。 我们最近发现,依赖于蛋白质特性,某些单克隆抗体可能在生理条件下保持稳定或降解。 以前的研究报道,一旦与人血清/血浆混合,颗粒就会分解。 在给药前产生的聚集物是否继续在体内循环,或者人类生理是否提供了一种环境,使聚集物逆转为其活性亚基(例如,单抗),这在很大程度上仍然是未知的。 虽然辅料的消除途径与TPs不同,但关于它们在体内的稳定性的认识也很少。 聚山梨酸酯(PS)可以通过氧化和水解机制进行降解,并形成PS颗粒。
在本研究中,我们通过加热、pH值、振荡和挤压四种应力条件生成mAb颗粒。 在本研究的第二部分,我们使用氢氧化钠水解降解生成PS颗粒。 蛋白和PS颗粒在生理条件下使用之前建立的无蛋白血清模型进行监测。 此外,我们在5°C和37°C的组氨酸缓冲液中跟踪生成的颗粒。 样品在两周内进行分析,并通过目视检查法、光阻法、尺寸排除色谱(HP-SEC)和FlowCam流式成像显微镜进行检测。
材料与方法
材料
免疫球蛋白G (IgG4)来自英国Slough Lonza Biologics,配制于10 mg/mL, 20 mM组氨酸缓冲液,pH 6.0。 单抗的生物物理特性列于表1。 聚氧乙烯20山梨醇单月桂酸酯NF和聚氧乙烯80山梨醇单月桂酸酯NF购自J.T. Baker®(Phillipsburg, NJ)。 仪器用缓冲液和体外模型缓冲液中含有组氨酸、盐酸、l -组氨酸一盐酸盐、一水合磷酸钠、氢氧化钠和磷酸二钠。 所有化学品均购自Sigma-Aldrich(圣路易斯,密苏里州)。 人血清取自Gemini生物制品公司(西萨克拉门托,CA)。Pierce Protein Concentrator PES,分子量为3 kDa, 5 - 20 mL购自ThermoFischer Scientific (Waltham, MA)。21G 40mm针头和不含硅油的Injekt®Solo注射器来自B. Braun Medical AG (Melsungen, Germany)。 所有样本置于2ml无菌Nalgene低温瓶(PETG培养基瓶,Sigma-Aldrich)中孵育。
蛋白质颗粒的生成:
将模型mAb置于不同的应力条件下,即:高温、振荡、挤压和pH变化条件下使蛋白质产生颗粒。 随应力条件改变,对产生的亚可见颗粒(sbvp)进行计数。 用20 mM组氨酸(pH 6.0)将单抗稀释至2 mg/mL,在施加应力前使用0.22 μm滤器进行过滤。 所有样品在应力作用后直接进行分析。
高温应力:在70°C条件下,将单克隆抗体(2ml)在恒温器(Eppendorf, Hamburg, Germany)中孵育3小时。 孵育后,将所有等分液冷却至室温并混合。
振摇应力:在Edmund Bühler GmbH™SM 30C数字通用振动筛(Bodelshausen,德国)中室温200转/分孵育21小时。
挤压应力:Aliquots (10ml)的mAb使用20ml无硅油Injekt®Solo注射器和21G 40mm针头,抽吸和挤出溶液80次。
pH诱导聚集:用盐酸(1 M)将2ml的mAb溶液从pH 6调整到pH 2,然后立即加入氢氧化钠(1 M)使其恢复到pH 6,在室温下进行施加此应力。
对照:14天监测无应力条件下的单抗。
表1模型单抗的生物物理性质。
• 在20 mM组氨酸缓冲液(pH 6.0)中配制并分析mAb
• 采用等电毛细管电泳法测定pI
• 免疫球蛋白:免疫球蛋白G
• pI:等电点。 用差示扫描量热法测定了熔化温度
• 用毛细管电泳法测定pI。
• pI用EMBOSS计算
聚山梨酯颗粒的生成
通过水解降解得到PS颗粒。PS20和PS80在1 M氢氧化钠中稀释至最 终浓度2.5% (w/v),在40°C和75%相对湿度下培养10天。 孵育后,用1 M盐酸中和至pH 7。 在加标前,PS样品在20 mM组氨酸缓冲液(pH 6.0)中稀释20倍。
生理学体外模型
本研究评估了无应力mAb、应力条件下mAb和应力条件下PS。37°C人血清滤液(HSF37°C)用于模拟体内条件。HSF37°C如前所述。 简单地说,使用3kda蛋白浓缩器通过离心超滤除去人血清中的大分子。 维持了温度、pH和渗透压等关键生理条件。HSF与20mm组氨酸缓冲液进行比较。 所有液体在使用前均经过0.22 μm过滤。 不同条件下的单克隆抗体加入4 mL上述液体中,使其最 终浓度达到0.2 mg/mL。 该浓度与临床血清样本中测定的浓度量级相同。 在三种液体中加入无应力单抗作为对照。 同样,为了监测PS颗粒在不同液体中的状态, 将降解的PS20和PS80在上述流体中加标,至理论浓度为0.0125% (w/ v)。 20mm组氨酸样品分别在5°C和37°C下置于冰箱和恒温器中孵育。HSF样品放置在含有6.5% CO2的培养箱中,保持在37°C和pH 7.4。 在20mm组氨酸5°C、20mm组氨酸37°C和HSF37°C下培养的样品,之后分别被称为His5、His37和HSF37°C。 所有样品在30分钟(T0h)、4小时(T4h)、24小时(T24h)、48小时(T48h)、7天(T7d)和14天(T14d)后对可见颗粒、亚可见颗粒和聚集物进行了表征。 本研究的潜伏期反映了已批准的单克隆抗体的半衰期,据报道中位半衰期为12-13天。 选择48 h内的4个时间点监测PS在暴露后的稳定性变化,特别是PS在体内降解速度较快。 只添加20mm组氨酸的液体用于监测模型/液体的稳定性。 所有样品和对照品均配制成三份。
pH
pH用SevenExcellence pH计(Mettler Toledo, Columbus, OH)测量。
可见颗粒
按照欧洲药典(2.9.20)规定的方法对样品和对照品进行可见颗粒检查。
光阻法
HIAC 9703 +配备HRLD-400检测器(Beckman Coulter, Brea, CA)和1ml Hamilton注射器,对sbvp进行分析。 以10 mL/min的流速抽取样品。根据欧洲药典(2.9.19) 使用光阻法对 SbVPs≥2、≥5,≥10,和≥25μm颗粒进行检测,但是更改了进样体积为0.2毫升。取4个连续的0.2 mL样本,最 后3次测量的数据取平均值并报告。仪器采用5 μm Count - cal Count Precision Size Standard beads (Thermo Fisher Scientific)标定。 数据采集使用PharmSpec软件(Beckman Coulter)。
高效尺寸排除色谱法
使用TSKgel SWXL型保护柱、TSKgel GS3000SWXL色谱柱(Tosoh Biosciences, Griesheim, Germany)和Waters Alliance e2695高效液相色谱系统(配备UV-Vis检测器)评估蛋白聚集物和片段。 用0.2 M磷酸钠缓冲液(pH 7.0)以0.5 mL/min的等容流速冲洗体系。 柱温保持在25˚C。 进样量为37.5 μL,在210 nm处测定吸光度。 色谱图使用Empower3软件进行处理(Waters, Milford, MA)。 进样前将样品在3000rpm下离心2min,以避免堵塞色谱柱。
流式成像显微镜
使用FlowCam (Fluid Imaging Technologies, Scarborough, ME)对T0h和T14d的sbvp进行成像,该设备配备有1 mL柱塞泵、10x NA/0.3 UPLFLN物镜(Olympus, Tokyo, Japan)、488 nm激光器和82 μm流通池。 分析前用5 × 1ml的水冲洗系统。 采用count - cal计数标准珠和10 μm NIST可溯源标准珠(Thermo Fisher Scientific)进行了粒度和计数的系统适用性测试。 手动将0.2 mL的预注射量注入流通池。 在0.1 mL/min的流速下,总共分析0.3 mL的样品。 使用Visual Spreadsheet软件4.2.52 (Fluid Imaging Technologies)获取图像并进行处理。
结果
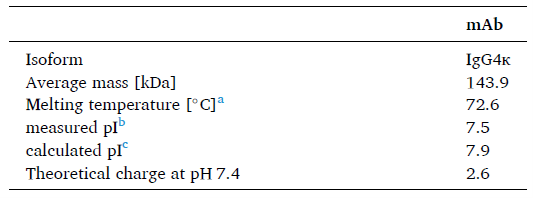
单克隆抗体粒子的状态:可见和亚可见颗粒将单克隆抗体置于不同的应力条件下产生蛋白质颗粒。 高温和pH应力是最严酷的条件,因为它们导致mAb溶液混浊,而挤压和振荡应力没有观察到明显视觉变化。 所有四种应力条件导致大量可见和亚可见颗粒。 为了研究液体对蛋白质颗粒的影响,在His5、His37和HSF37°C中分别添加了应力条件下单抗溶液,使其最 终浓度为0.2 mg/mL。 在所有3种液体中都有少量可见颗粒残留。
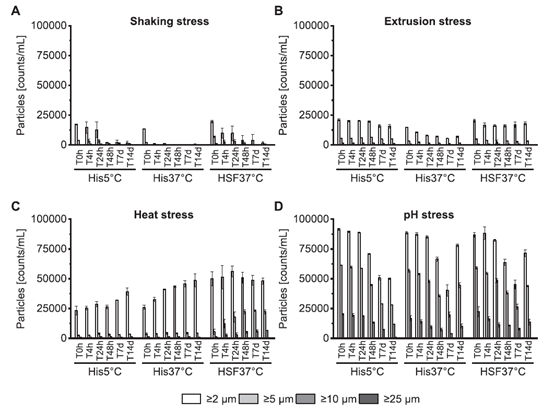
图1所示。 蛋白颗粒SbVP分析。 (A)振摇应力(B)挤压应力(C)热应力(D)单抗在His5、His37和HSF37°C下的pH应力的LO数据。 对SbVP的累积计数≥2、≥5、≥10和≥25 μm进行了表征。 所有条形表示为平均值±标准差。 每个样品制备三份,在每个时间点测量一次。n = 3。
图1显示了各应力状态下的SbVP计数与His5、His37和HSF37°C的差异。 绝大多数sbvp≥2 μm(白条)。 在T0h时,所有四种应力条件下≥2um的颗粒数都超过了LO检测仪的上限。 对于振动诱导的颗粒(图1A),三种流体的计数都随着时间的推移而下降。 这一趋势在His37°C中最明显,其中SbVP计数在4小时内减少到小于1000个≥2 um的颗粒,并在整个孵化期间保持在这个值。 此外,在His37°4小时内可减少颗粒数量。挤压诱导的颗粒(图1B)仅在His37°中可溶解。 在剩下的液体中,颗粒数随时间保持不变。 热诱导颗粒(图1C)显示出不同的趋势。 我们观察到His5°C和His37°C的颗粒数稳步增加。HSF37°C在整个孵育期间,≥5 μm的颗粒(浅灰色条)持续增加。 在所有液体中,ph诱导颗粒的SbVP计数最 高。 随着时间的推移,三种液体中的SbVP数量都在下降。 然而,His37°C和HSF37°C在T14d显示颗粒数增加。 与其他应力条件相比,pH应力颗粒显示出更高的≥5 um计数。 所有不带标配单抗的流体(His5°C、His37°C和HSF37°C)在整个培养期内保持稳定(即≥2 μm颗粒数<100)。 作为额外的对照,我们监测了无应力模型单克隆抗体的SbVP计数。SbVP数没有明显的变化超过14天,表明稳定性好马伯的组氨酸缓冲区和血清滤液关于蛋白质聚合(补充图1)。图2显示了代表图像每个在初始应力状态的SbVPs (T0h)和最 后的时间点(T14d)。 流式成像法(FlowCam)数据能够表达蛋白颗粒。

图2所示。 蛋白SbVP的代表性图像。 左图显示了在T0h HSF中四种应力条件下产生的sbvp图像。 右侧面板显示了T14d的图像。
蛋白质聚合体和片段的命运:HP-SEC分析
使用HP-SEC的LMWS(图3)。热应力样品没有获得吸光度,可能是由于蛋白质的沉淀。 振动和挤压应力导致低HMWS(<1%),几乎与无应力控制的单抗水平相当(补充图2)。在14天内,没有观察到任何应力条件下的显著变化。 事实上,在这两种应力条件下,初始时间点(T0h)和最 终时间点(T14d)之间的变化与未施加应力的单抗相似(补充图2)。pH应力导致三种流体在峰值后产生20 - 30%的聚集物(图3C)。 有趣的是,不同液体在T0h时的HMWS差异很大。ph诱导的聚集体随着时间的推移而溶解。 在整个孵育期间,His37°C和HSF37°C的HMWS持续下降,单体增加。 单体峰面积的增加与培养时间的增加完全一致,表明聚集体的溶解(补充图3)。然而,必须注意的是,pH胁迫下的样品的峰强度比未胁迫下的样品低5倍。 在His5°C中HMWS的降低和单体的增加不太明显。 各胁迫条件下LMWS最小(<1%)。 尽管可以忽略不计,pH胁迫也导致了稍高的LMWS含量,随着时间的推移,其含量下降到与未胁迫样品相当的值。 根据应力条件的不同,骨料的组成也不同。 二聚体洗脱约15分钟后,低聚体的滞留时间在11到15分钟之间(补充图3)。ph诱导的聚合体在T0h时由二聚体(10-12%)和低聚体(9-16%)组成(补充图4)。而振荡和挤压诱导的聚合体几乎完全是二聚体,只包含约0.04-0.1%的低聚体。 在His37°C和HSF37°C中,ph -应力产生的低聚物随时间持续减少。 在His5˚C中,二聚体在最初下降后增加。
PS粒子的状态:可见颗粒和亚可见颗粒
作为研究的第二部分,在His5、His37和HSF37°C中添加了水解降解的PS20和PS80。 图4显示了14天内液体中的颗粒数。 对于PS20和PS80,与其他液体相比,HSF37°C的尖刺导致sbvp更多。PS20聚集体似乎在His37°C下解体,14天后仅剩下约500个≥2 μm的颗粒(白色条)。 然而,在His 5°C和HSF37°C中未见明显变化。PS80的降解比PS20更明显,因为在T0h时,PS80的颗粒数是PS20的两倍。PS80≥2 μm和≥5 μm颗粒在His5和His37°C中溶解,而在HSF37°C中保持相当高的计数。 与PS20颗粒相似,PS80颗粒在His37°C中几乎完全溶解(约600粒子> 2 μm)。 流动成像获得的PS颗粒对应图像如图5所示。
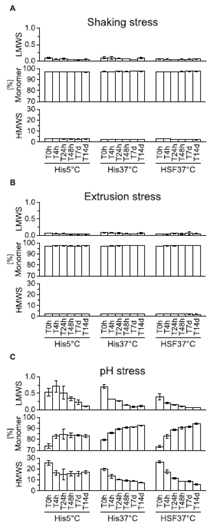
图3所示。 使用HP-SEC分析降解的单抗。 振荡应力(A)、挤压应力(B)和pH应力mAb (C)在六个时间点在三种液体中测量。 所有条形表示为平均值±标准差。 每个样品制备三份,在每个时间点测量一次。n = 3。 值得注意的是,热应力样品只获得基线吸光度。
图4所示。 降解PS20和PS80在不同液体中的颗粒分析。PS20 (A) PS80 (B)。所有条形表示为平均值±标准差。 每个样品制备三份,在每个时间点测量一次。n = 3。
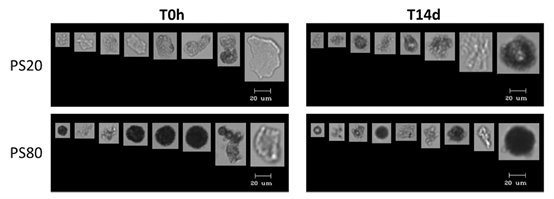
图5所示。PS粒子的代表性图像。 左面显示了PS20和PS80颗粒在T0h的HSF中的图像,右面显示了T14d的图像。
讨论
我们在His5°C中跟踪了蛋白颗粒的稳定性,在最近的一项研究中,我们已经证明了使用无蛋白血清滤液比在体外稳定性较差的纯生物液体的好处。 诱导颗粒的应力条件进行了调整,以达到可比较的sbvp计数。 在这四种应力条件下,所有三种流体的颗粒数都很高。 高温和pH应力是最严酷的条件,导致溶液浑浊,产生了大量可见颗粒。
蛋白质颗粒的结合可以是可逆的,也可以是不可逆的。 蛋白质颗粒是高度动态的,即使在他们的环境中一个微小的变化都可以导致不同的性质,计数,大小,形态等。Kiese等人表明,振摇产生的IgG1的sbvpp是可逆的,而热应力引起的聚集即使在5°C和25°C下静态存储12个月后仍然存在。 我们的研究显示了相同的趋势,即振动诱导的颗粒在所有三种流体中都是可逆的。 有趣的是,在His37°C中,振摇诱导的颗粒在4小时内溶解到可以忽略的水平,这表明可能存在非共价相互作用。 非共价蛋白质的相互作用通常是由弱作用力如疏水作用、氢键作用和静电作用引起的。 相反,在所有流体中,热应力诱导颗粒随时间增加。 特别是在HSF中,颗粒尺寸随时间显著增加,表明进一步的自聚集。 这在预料之中,因为热应力条件接近本研究中使用的单克隆抗体的熔化温度(Tm: 72.6°C)。 在熔点,蛋白质展开,暴露出疏水核心。 此外,高温促进了暴露半胱氨酸之间的二硫键的形成,这可能会导致不可逆聚集。 这些蛋白质聚集体之间的共价相互作用,可能有助于观察到的不可逆相互作用。 令人惊讶的是,挤压引起的颗粒仅在His37°C中溶解,而在His5和HSF37°C中变化很小。 机械应力,如挤压或振摇,通常导致非共价自然溶解和不溶解的聚集。 剪切应力增加单克隆抗体的表面暴露,促进分子间疏水相互作用。 然而,这些疏水作用通常是可逆的,并取决于温度和溶剂的离子强度。 在所有应力条件中,pH应力导致sbvp数量最多。 这与Filipe等人之前的一项研究一致,在该研究中,pH应力下的样品具有最 高的颗粒计数。 对照样本(无压力单克隆抗体)在所有液体中孵育两周后仍保持稳定。
在所有三种液体中加入热诱导颗粒,HP-SEC的基线值为,即在214 nm处没有测量到吸光度。 这表明蛋白质沉淀作为大的聚集物会被保护柱或色谱柱过滤掉。 此外,由于增大了“粘性”,大的或变性的聚集体更倾向于不可逆地与柱基体结合。HP-SEC数据与我们的LO分析一致,因为热应力似乎会严重降解单抗。HP-SEC结果表明,pH应力下的样品也被严重降解。 单体峰强度比无应力单抗低5倍左右。 在pH应力下,三种液体的可溶性团聚体在T0d时约为20-30%。 有趣的是,在T0d的峰值后,观察到液体之间的HMWS差异。 可能有各种各样的因素,如温度、pH值和电解质组成对颗粒的瞬时溶解度有贡献。 随着时间的推移,蛋白质聚集物溶解在这三种液体中。 与His5°C相比,在His37和HSF37°C中,温度似乎提高了溶解度,因为HMWS降低的程度更高。 引人注目的是,在两周的孵育期间,单体含量增加了20%。 振摇和挤压应力不诱导可溶性聚集,因为HMWS的比例与未施加应力的单抗相当。 此外,在这些应力条件下,HMWS和LMWS在2周内没有变化。 聚合体的组成也不同。pH应力下的样品由二聚体和低聚体组成,而振荡和挤压胁迫下的单抗主要由二聚体组成。 对于pH应力下的聚集体,低聚体转变为二聚体,二聚体转变为单体。 单体峰值的增加突出了这一点。 结果表明,颗粒的性质和患者的状况可以对颗粒的状态产生影响。 它们可以保持稳定,继续聚合,甚至解体。
我们的研究表明,本研究中使用的生理液体(HSF)可以对蛋白质产生稳定作用。 由于His37°C和HSF37°C的结果往往显示出相似的趋势,我们假设37°C的体温可能会积极影响颗粒的溶解。 我们还表明,这种效应取决于蛋白质聚合体的性质。 蛋白质聚集强烈依赖于蛋白质的性质和溶剂条件,如温度、pH值、电解质组成和表面活性剂。 在振荡应力或挤压应力下的任何液体中,都没有观察到可溶性聚集体的实质性解体。 这些不同的趋势强调了在个案基础上进行调查的重要性。
在本研究的第二部分,我们对PS粒子的稳定性进行了监测。 虽然化学水解的可能性是低储存期间,我们采用碱介导水解加速粒子的形成。 水解应激导致游离脂肪酸的形成,这些脂肪酸容易形成不溶性颗粒。PS20和PS80降解后,经LO测定,≥2 μm的粒子数均超过10,000。 与PS20相比,PS80显示了更明显的退化,其计数是PS20的两到三倍。PS80主要由油酸酯组成,还有少量的亚油酸酯、棕榈酸酯、棕榈油酸酯和硬脂酸酯。 这种长链脂肪酸的溶解度较低,因此颗粒率较高。 有趣的是,PS20和PS80 sbvp在His37˚C中几乎完全溶解。PS20和PS80的His5°C差异,只有PS80溶解。 在14天的潜伏期内,PS20和PS80颗粒均保持在HSF37°C状态。 这种状态上的差异可以归因于温度、电解质浓度和流体pH值的差异。sbvp可能随着温度的升高而溶解,这是由于降解物溶解性的变化。 同样地,游离脂肪酸如棕榈酸或硬脂酸的溶解度也会受到ph值的影响。然而,由于PS固有的分子异质性会导致高批量的变异,因此所得结果不应被推广。
我们表明,降低生物液(如血清)的基质复杂性有利于SbVP对治 疗蛋白的分析。 我们之前的研究表明,关键的生理参数,如温度、pH和渗透压,在剥离血清大分子后仍然存在。 由于基质的复杂性较低,数周的潜伏期可能会增加生理相关性。 此外,可以使用各种分析仪器,这些分析仪器由于基质干扰通常不适用于或只部分适用于纯净的生物流体。 然而,基质成分如蛋白质、细胞和酶的缺乏也可能错过发生在体内的重要现象。 这些事件可能包括蛋白质-蛋白质相互作用或酶驱动的降解过程。Luo等人在体外条件下表明,治 疗蛋白可能与血浆蛋白相互作用。 与我们在HSF37°C中发现的PS颗粒相反,Saggu等人表明,用0.9%生理盐水稀释后,游离脂肪酸颗粒溶解,暴露于人血浆中,颗粒尺寸没有增加。 与我们的无蛋白人血清滤液相比,这些差异是由于人血浆造成的,还是由于PS降解及其脂肪酸组成的差异尚不清楚。 虽然监管指南要求对≥10 μm和≥25 μm的颗粒进行分析,但我们的观察结果与先前的研究一致,表明在生理条件下,< 10 μm的蛋白颗粒会形成。TPs和内源性化合物如蛋白质和细胞可能在体内相互作用,改变其生理行为,从而改变免疫原性潜能。
总的来说,聚集是一种高度复杂的现象,涉及各种促成因素和机制。 溶剂条件可以促进聚集或分解。 由于混杂因素的大量存在,确定蛋白质和聚苯乙烯颗粒这种不同行为的准确参数是非常具有挑战性的。 尽管如此,目前的研究强调了在生理条件下研究颗粒命运的重要性,因为这种降解物可以在制造/存储过程中获得。 需要进一步的研究来确定应力条件和颗粒在体内的命运之间的明确的相关性
结论
我们在之前开发的人血清滤液模型中研究了mAb和PS颗粒的聚集/分解行为。 开发的模型能够有效监测颗粒和聚集在不同的体系中超过2周的孵化,而无需任何额外的样品操作。 虽然我们的模型缺乏可能影响聚集行为的血清蛋白(例如酶驱动聚集和治 疗蛋白和内源性蛋白之间的蛋白-蛋白相互作用),但该模型提供了一个稳定的平台,可用于进行高通量筛选。 无应力单抗在液体中没有明显聚集,而不同应力条件下产生的单抗聚集在模拟给药后表现出不同的行为。 同样,PS颗粒根据体系和孵育条件具有不同的聚集动力学。 对于PS20和PS80颗粒,HSF37°C似乎可以稳定聚集物,因为它们不会随着时间溶解。 我们的结果表明,颗粒可以溶解甚至聚集进一步取决于性质的压力和颗粒所受的环境。 颗粒物和聚集体的不同状态特别提醒了在监测它们状态的重要性。 这样的研究将有助于评估聚集物在早期临床前阶段的潜在状态。
流式颗粒成像分析系统

动态成像颗粒分析系统具有行业领先成像质量和自动识别统计的软件,是检测,表征和定量各种油气行业应用的有效工具。
主要功能:
• 自动清洗和循环清洁功能能够有效避免交叉污染
• 标准分析效率 = 250 µl/min
• 可以选择配置FlowCam自动液体处理系统(ALH)
• VISUALSPREADSHEET软件
• 根据您设定的条件对颗粒数据进行分类和筛选。
• 使用复杂图形识别软件对所有相似颗粒进行分组
• 通过创建和保存用户自定义的颗粒类型数据库就可以实现自动分类和统计分析
• 即时计算汇总总计和生成交互图表


欢迎联系大昌华嘉科学仪器部:
400 821 0778
ins.cn@dksh.com
www.dksh-instrument.cn
大昌华嘉科学仪器部产品目录
仪器设备:
- 激光粒度分析仪、颗粒图像分析系统
- 光学接触角测量仪、表/界面张力仪
- 比表面及孔隙度分析仪、化学吸附仪
- 手持式拉曼光谱仪
- 全自动真密度分析仪
- 密度计/旋光仪/折光仪/糖度仪
- 全自动氨基酸分析仪
- TOC总有机碳分析仪
- 总有机卤素分析仪、硫氮氯分析仪
- 元素分析仪
- 总氮/蛋白质分析仪
- 台式X射线荧光光谱仪
- 三维X射线显微成像系统
- 流式颗粒成像分析系统
- 薄层扫描仪、点样仪
- 水份活度仪
- 纳米颗粒跟踪分析仪、颗粒电位滴定仪
- 粉末流动性分析仪
- 全自动反应量热仪
- 火焰光度计、氯离子分析仪
- 闪点测试仪、蒸馏仪、蒸汽压测试仪、中红外油品分析仪
- 粉体流动性分析仪、粉体振实密度分析仪、粉体剪切性能分析仪、粉体静电吸附性能分析仪
- 稳定性分析仪(多重光散射仪)、扩散波光谱仪(光学法微流变)、微流控可视流变仪、结晶分析仪(相变分析仪)、动态干燥度分析仪

- 标签: 流式颗粒成像分析系统 , 动态成像颗粒分析系统
- 收藏(0) 赞(0) 踩(0)
-
 随时了解更多仪器资讯,求购、招标、中标信息实时更新,厂商招商信息随时看。大量、齐全、专业的仪器信息尽在仪器网(yiqi.com)。扫一扫关注仪器网官方微信,随时随地查看仪器用户采购、招标需求!
随时了解更多仪器资讯,求购、招标、中标信息实时更新,厂商招商信息随时看。大量、齐全、专业的仪器信息尽在仪器网(yiqi.com)。扫一扫关注仪器网官方微信,随时随地查看仪器用户采购、招标需求!
-
为你精选
-
 江苏跨境电商进出口额实现快速增长 哪些仪器有望受益跨境电商?
今年以来,江苏大力推动跨境电子商务高质量发展。 持续提升货运专线服务能力和覆盖范围,打造特色跨境电商产业带。 跨境电商进出口额实现快速增长。
2024-04-16 11:20:44 业内交流
江苏跨境电商进出口额实现快速增长 哪些仪器有望受益跨境电商?
今年以来,江苏大力推动跨境电子商务高质量发展。 持续提升货运专线服务能力和覆盖范围,打造特色跨境电商产业带。 跨境电商进出口额实现快速增长。
2024-04-16 11:20:44 业内交流 -
 华为助力金融行业加速拥抱AI 仪器行拥抱AI有哪些机遇和发展?
据华为数据存储微信ID显示,4月11日,以“数字创造未来,智慧金融”为主题的2024华为金融创新数据基础设施峰会在重庆举行。 在本次峰会上,华为数据存储产品线总裁周跃峰正式发布了金融行业四大解决方案。
2024-04-15 10:45:52 业内交流
华为助力金融行业加速拥抱AI 仪器行拥抱AI有哪些机遇和发展?
据华为数据存储微信ID显示,4月11日,以“数字创造未来,智慧金融”为主题的2024华为金融创新数据基础设施峰会在重庆举行。 在本次峰会上,华为数据存储产品线总裁周跃峰正式发布了金融行业四大解决方案。
2024-04-15 10:45:52 业内交流 -
 国家发改委确立煤炭产能储备制度 有序建设储备煤矿项目哪些仪器将受益?
我们需要了解什么是煤炭产能储备制度。这是一种政府为了应对可能出现的能源供应短缺或其他突发情况,而提前储备一定数量的煤炭生产能力的制度。这需要在正常生产之外,再额外建设一些煤矿,以备不时之需。
2024-04-12 16:58:33 业内交流
国家发改委确立煤炭产能储备制度 有序建设储备煤矿项目哪些仪器将受益?
我们需要了解什么是煤炭产能储备制度。这是一种政府为了应对可能出现的能源供应短缺或其他突发情况,而提前储备一定数量的煤炭生产能力的制度。这需要在正常生产之外,再额外建设一些煤矿,以备不时之需。
2024-04-12 16:58:33 业内交流 -
 央行加大对住房保障体系经融支持力度 地产重构经营模式带来哪些仪器行业机遇?
住房保障体系的完善和房地产市场的稳定发展,将促进相关产业链的拓展和完善。其中,检测和认证服务将成为重要的一环。从建材的质量检测到室内空气环境的评估,都需要专业的仪器设备来完成。
2024-04-07 13:30:11 业内交流
央行加大对住房保障体系经融支持力度 地产重构经营模式带来哪些仪器行业机遇?
住房保障体系的完善和房地产市场的稳定发展,将促进相关产业链的拓展和完善。其中,检测和认证服务将成为重要的一环。从建材的质量检测到室内空气环境的评估,都需要专业的仪器设备来完成。
2024-04-07 13:30:11 业内交流 -
 中国成功研发双向脑机接口芯片 对新型医疗器械研发有何指导作用?
到目前为止,国外脑机接口芯片只能实现3000多个通道,而且是单向的。 黄立此前接受采访时表示,马斯克的脑机接口需要将传感器逐个植入脑组织,操作时间较长。 但中国脑机的65000个通道是一次性植入的。
2024-03-22 10:39:57 业内交流
中国成功研发双向脑机接口芯片 对新型医疗器械研发有何指导作用?
到目前为止,国外脑机接口芯片只能实现3000多个通道,而且是单向的。 黄立此前接受采访时表示,马斯克的脑机接口需要将传感器逐个植入脑组织,操作时间较长。 但中国脑机的65000个通道是一次性植入的。
2024-03-22 10:39:57 业内交流
-
抗体和聚山梨酯颗粒在人血清模型中的状态

①本文由仪器网入驻的作者或注册的会员撰写并发布,观点仅代表作者本人,不代表仪器网立场。若内容侵犯到您的合法权益,请及时告诉,我们立即通知作者,并马上删除。
②凡本网注明"来源:仪器网"的所有作品,版权均属于仪器网,转载时须经本网同意,并请注明仪器网(www.yiqi.com)。
③本网转载并注明来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
④若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi
- BET系列新品即将发布!国仪量子邀您参加CIBF2024
- 直播预告 | Amira软件在细胞生物学上的可视化分析演示
- 再获殊荣 | 奥豪斯磁力搅拌器荣获A'Design 大奖
- 从教学到科研,瑞士万通电化学及拉曼产品全面助力科研焕新
- 入会提醒 | 2024年第三期扫描电镜高阶应用线上培训
- 澳柯玛生物医疗亮相第61届中国高等教育博览会
- 荣获康宁连续流反应器和流动化学国际杰出成就大奖
- 线下展会 | TCT亚洲展上海与您有约
- 探索生命之光,让每一次检测都清晰可见!
- 瑶安 | 无视燃气报警器报警,天然气持续泄漏爆炸致17人死伤,经济损失367万!
- 正式介绍一款新设备——岩相精密切割&研磨一体机
- 按图索骥:空间组学开启生命微观世界新纪元 ——系列纪录片《探寻生命的秘密》第二部“空间多组学”即将上映
- 土壤/沉积物中的有机碳、无机碳及元素碳检测方案 | 德国元素





