- 2022-07-23 16:10:09 来源:徕卡显微系统(上海)贸易有限公司 浏览量:165次
- 【导读】我们的研究目标是使用同步UMR106-01培养模型设计并验证一种伪非水处理方法
-
在成骨细胞培养物中矿物晶体成核之前,冷冻替代可以提高钙和磷离子的保留和可视化
骨矿化的细胞培养模型:UMR106-01细胞的速度更快,时间同步,产生更多矿物质
我们使用培养的UMR106-01成骨细胞来研究骨矿化过程。UMR106-01细胞以及初级颅骨细胞组装球形细胞外超分子蛋白脂质复合物,称为生物矿化灶(BMF),其中沉积了第 一批羟基磷灰石矿物晶体(Midura等人,2004年;Wang等人,2004年)。这些培养模型之间的一个主要差异是矿化发生的速度,从原代成骨细胞电镀后的12-16天到UMR106-01细胞的88小时不等。
如果忽略磷酸盐来源或添加丝氨酸蛋白酶抑 制剂AEBSF阻止矿化,则会形成BMF复合物,但不会发生矿化。有趣的是,超结构研究表明,在矿化之前,BMF含有许多膜限制的囊泡,大小从50纳米到2微米不等。然而,第 一批矿物晶体直到UMR106-01细胞电镀78小时后才被检测到,并且这些晶体定位在假定为囊泡的球形位置内。
具体而言,共焦拉曼光谱分析表明,BMF内的矿化是一个渐进的多步骤过程,同时发生在培养瓶内的所有BMF中(Wang等人,2009年)。重要的是,在结晶性差的羟基磷灰石沉积之前,在每个BMF中可以检测到一些蛋白质光谱变化,当矿化被阻断时,这些变化则不会发生。因此,BMF内的矿化是一个时间同步过程。然而,了解矿化的生化机制需要在BMF内结晶成核之前详细了解钙和磷离子的处理。
钙和磷的溶解性以及当前的水溶液方法是否排除了对生物矿化过程中初始囊泡事件的超微结构分析?
之前的研究已经提出,软骨和/或骨矿化利用单个富含钙和磷的囊泡群,或利用两个分别富含钙或磷的囊泡群(图1)(Anderson,1967年;Bonucci,1967年;Arsenault和Ottensmeyer,1984年)。为了澄清这一问题,需要对这些离子的溶解度采取额外的方法,如高压冷冻和冷冻替代,以避免标本固定、嵌入和切片过程中的损失。由于之前的大多数研究都没有在标本处理过程中全程避免用水,因此很难评估伪非水处理对成骨细胞介导的矿化过程的真正影响。
我们的研究目标是使用同步UMR106-01培养模型设计并验证一种伪非水处理方法,以在BMF中第 一批羟基磷灰石晶体成核之前,将BMF中钙和磷离子的分布立即成像(图1)。我们认为,这种方法也适用于研究其他细胞(如肌肉)中钙离子分布的时间变化。
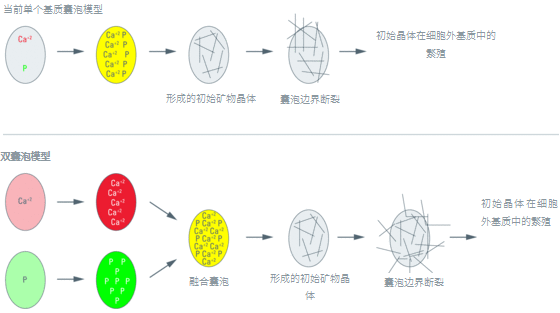
图1:细胞外矿化的单囊泡和双囊泡模型。上图为单个基质囊泡模型。钙和磷离子通过Ca+2-泵送ATP酶、Na+-磷酸盐共转运体和作用于磷脂的磷酸酶的建议作用逐渐集中在单个基质囊泡群中。一旦Ca+2和磷酸盐离子达到阈值浓度(黄色),就会发生初始矿物晶体的成核,导致囊泡破裂并释放晶体,从而在周围的细胞外胶原基质中繁殖额外的晶体。下图为双囊泡模型。钙和磷逐渐集中在两个不同的囊泡群中,这些囊泡在生物化学上表现出不同的功能分布,分别包括Ca+2泵送ATP酶和Na+-磷酸盐共转运体活性。随后,这些富含钙和磷的囊泡群融合并形成有核矿物晶体,导致囊泡破裂并释放晶体,从而在周围的细胞外胶原基质中繁殖额外的晶体。
高压冷冻、冷冻替代或常规固定样品会损失钙和磷
在矿化成骨细胞培养中,使用高压冷冻和冷冻替代不足以保留不稳定的钙和磷
在高压冷冻和冷冻替代后或常规固定过程中,样品中的钙和磷可能会丢失。为了评估我们的伪非水方法的有效性,我们选择在76小时停止培养,即在添加ß-甘油磷酸盐矿化刺激物后12小时,但在BMF内第 一批矿物晶体出现前2小时停止培养(Midura等人,2004;Wang等人,2009年)。随机选择一些培养物用于常规固定处理(图2),而其他培养物则通过高压冷冻(徕卡EMPACT)和冷冻替代(图3)进行处理。对这些成对培养物的比较支持了几个结论。在常规固定后,较大区域含有略微均匀的颗粒状有机基质。这些区域似乎将膜限制的囊泡排除在其体积之外。相比之下,高压冷冻培养物在BMF内含有大量几乎呈“白色”的细胞外区域,直径约为0.5–1μm(箭头,图3)。
在高倍视图中,可以明显看到,尽管对比度较低,但这些“白色”区域确实具有一个基本细节,它代表了一系列直径约为50到800纳米的不规则球形物体(未显示)。然而,这些“白色”区域的存在立即引起了人们对无机或有机物质丢失的担忧。特别是,当与成对的、常规固定培养物中的类似BMF区域进行比较时(图2),我们假设“白色”斑点代表的是高压冷冻优先保留的材料,但在进一步处理后会丢失。
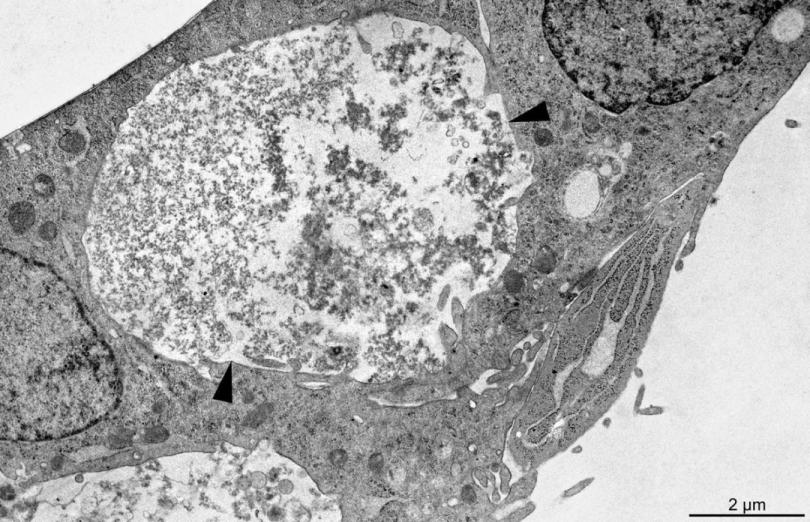
图2:常规化学固定和湿切片后矿化成骨细胞培养中出现BMF。UMR106-01细胞在ß-甘油磷酸存在的情况下培养了12小时。箭头定义了富含略微均匀的颗粒状有机基质的细胞外BMF的轮廓。
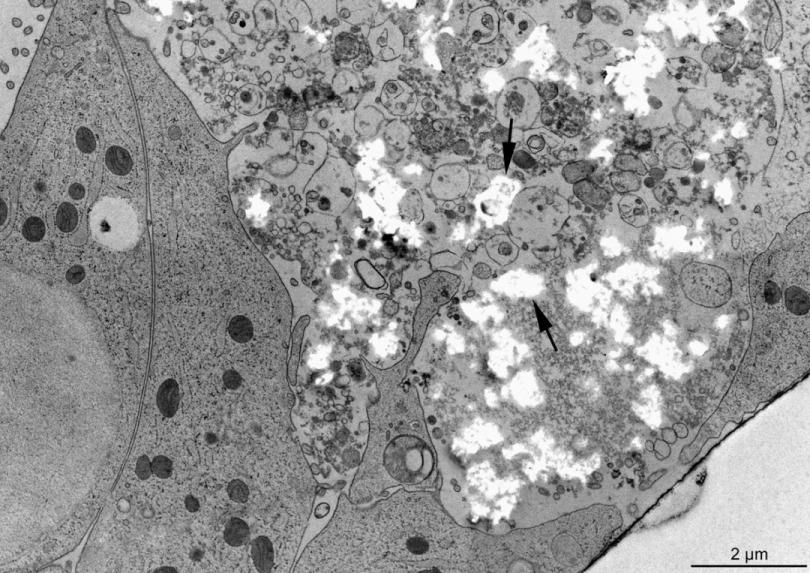
图3:高压冷冻、冷冻替代的成骨细胞培养物含有带有半透明斑点(箭头)的BMF,这些斑点是对比度较差的细胞外基质区域。与干燥切片的类似样品相比,半透明斑点呈黑色(见图4)。
在干切片高压冷冻、冷冻替代培养物中,钙和磷的保留率有所提高
并列比较显示,为了观察矿化成骨细胞培养物中富含钙和磷的细胞外囊泡群,需要将干切片与高压冷冻和冷冻替代相结合
应注意的是,无论是在常规固定的样品中,还是在湿切片的冷冻替代样品中,无论样品是否经过染色,钙和磷的后续电子光谱成像都不可能实现(结果未显示)。因此,我们将高压冷冻、冷冻替代培养物的干切片替换为湿切片。在干切片高压冷冻、冷冻替代培养物中,钙和磷的保留率有所提高。很明显,干切片的替代会导致生物矿化灶内钙和磷的保留显著增加[比较图3(湿切片)和图4(干切片)]。
在湿切片后,图3中直径为0.5–1μm的焦点区域内显示为“白色”斑点,现在在零损耗能量图像中显示为黑色(图4A)。UMR106-01培养物以可重复、时间同步的方式进行矿化,有助于不同培养物之间的直接比较(Wang等人,2009年)。此外,电子光谱成像显示暗显区域富含钙和磷(对比图4A、B和C)。
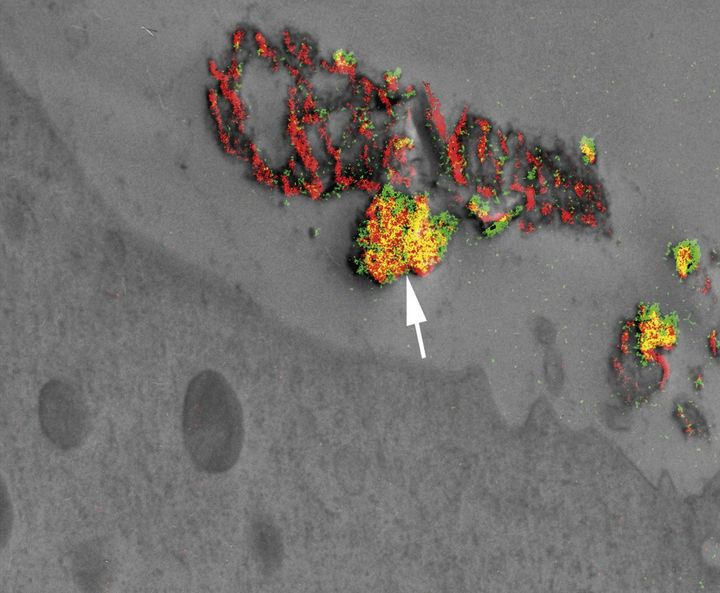
最 后,如图4D中的叠加图像所示,在76小时培养中,钙(红色)和磷(绿色)信号在很大程度上相互重叠,如黄色所示。由于其他研究表明,76小时的UMR106-01培养物中不含可检测的矿物晶体(Huffman等人,2007年;Wang等人,2009年),因此此处观察到的钙和磷的富集含量可能代表无定形磷酸钙(Driessens等人,1978年)和/或磷的不稳定有机形式,如聚磷酸盐(Omelon等人,2009年)。
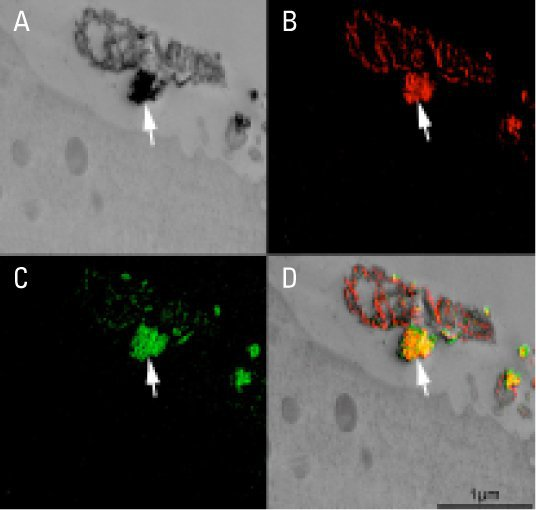
图4:经过伪非水处理后,矿化的BMF富含钙和磷。细胞的生长方式与图2和图3所示相同。A: 描绘暗显囊泡的零损耗能量图像。B: 钙信号的电子光谱成像。C:磷的电子光谱成像。D:A–C中视图的叠加图像。
重要的是,未矿化对照培养物的分析支持了观察到的矿化中钙和磷的富集焦点含量的功能作用。当对未矿化的UMR106-01培养物采取类似的高压冷冻、冷冻替代和干切片方法时,几乎没有检测到黑色(富含钙和/或磷)囊泡或颗粒(未显示)。最 后,使用震动刀的另一个优点在于减少了切片过程中的压缩,并减少了合成切片的起皱。
结 语
总之,我们的结果表明,在矿化成骨细胞培养中,需要高压冷冻和伪非水处理来检测早期钙和磷富集的细胞外位点。事实证明,使用干切片是保存钙和磷的关键步骤。此外,电子光谱成像显示,在检测到结晶矿物之前,细胞外生物矿化灶内的深色染色囊泡富含钙和磷(Wang等人,2009年)。我们目前计划使用这种方法来确定体外和体内的成骨细胞是否采取单或双囊泡矿化机制(Gorski等人,2004年;Midura等人,2009年)。
- 标签:共焦拉曼光谱 , 电子光谱成像
- 收藏(0) 赞(0) 踩(0)
-
 随时了解更多仪器资讯,求购、招标、中标信息实时更新,厂商招商信息随时看。大量、齐全、专业的仪器信息尽在仪器网(yiqi.com)。扫一扫关注仪器网官方微信,随时随地查看仪器用户采购、招标需求!
随时了解更多仪器资讯,求购、招标、中标信息实时更新,厂商招商信息随时看。大量、齐全、专业的仪器信息尽在仪器网(yiqi.com)。扫一扫关注仪器网官方微信,随时随地查看仪器用户采购、招标需求!
-
为你精选
-
 江苏跨境电商进出口额实现快速增长 哪些仪器有望受益跨境电商?
今年以来,江苏大力推动跨境电子商务高质量发展。 持续提升货运专线服务能力和覆盖范围,打造特色跨境电商产业带。 跨境电商进出口额实现快速增长。
2024-04-16 11:20:44 业内交流
江苏跨境电商进出口额实现快速增长 哪些仪器有望受益跨境电商?
今年以来,江苏大力推动跨境电子商务高质量发展。 持续提升货运专线服务能力和覆盖范围,打造特色跨境电商产业带。 跨境电商进出口额实现快速增长。
2024-04-16 11:20:44 业内交流 -
 华为助力金融行业加速拥抱AI 仪器行拥抱AI有哪些机遇和发展?
据华为数据存储微信ID显示,4月11日,以“数字创造未来,智慧金融”为主题的2024华为金融创新数据基础设施峰会在重庆举行。 在本次峰会上,华为数据存储产品线总裁周跃峰正式发布了金融行业四大解决方案。
2024-04-15 10:45:52 业内交流
华为助力金融行业加速拥抱AI 仪器行拥抱AI有哪些机遇和发展?
据华为数据存储微信ID显示,4月11日,以“数字创造未来,智慧金融”为主题的2024华为金融创新数据基础设施峰会在重庆举行。 在本次峰会上,华为数据存储产品线总裁周跃峰正式发布了金融行业四大解决方案。
2024-04-15 10:45:52 业内交流 -
 国家发改委确立煤炭产能储备制度 有序建设储备煤矿项目哪些仪器将受益?
我们需要了解什么是煤炭产能储备制度。这是一种政府为了应对可能出现的能源供应短缺或其他突发情况,而提前储备一定数量的煤炭生产能力的制度。这需要在正常生产之外,再额外建设一些煤矿,以备不时之需。
2024-04-12 16:58:33 业内交流
国家发改委确立煤炭产能储备制度 有序建设储备煤矿项目哪些仪器将受益?
我们需要了解什么是煤炭产能储备制度。这是一种政府为了应对可能出现的能源供应短缺或其他突发情况,而提前储备一定数量的煤炭生产能力的制度。这需要在正常生产之外,再额外建设一些煤矿,以备不时之需。
2024-04-12 16:58:33 业内交流 -
 央行加大对住房保障体系经融支持力度 地产重构经营模式带来哪些仪器行业机遇?
住房保障体系的完善和房地产市场的稳定发展,将促进相关产业链的拓展和完善。其中,检测和认证服务将成为重要的一环。从建材的质量检测到室内空气环境的评估,都需要专业的仪器设备来完成。
2024-04-07 13:30:11 业内交流
央行加大对住房保障体系经融支持力度 地产重构经营模式带来哪些仪器行业机遇?
住房保障体系的完善和房地产市场的稳定发展,将促进相关产业链的拓展和完善。其中,检测和认证服务将成为重要的一环。从建材的质量检测到室内空气环境的评估,都需要专业的仪器设备来完成。
2024-04-07 13:30:11 业内交流 -
 中国成功研发双向脑机接口芯片 对新型医疗器械研发有何指导作用?
到目前为止,国外脑机接口芯片只能实现3000多个通道,而且是单向的。 黄立此前接受采访时表示,马斯克的脑机接口需要将传感器逐个植入脑组织,操作时间较长。 但中国脑机的65000个通道是一次性植入的。
2024-03-27 10:39:57 业内交流
中国成功研发双向脑机接口芯片 对新型医疗器械研发有何指导作用?
到目前为止,国外脑机接口芯片只能实现3000多个通道,而且是单向的。 黄立此前接受采访时表示,马斯克的脑机接口需要将传感器逐个植入脑组织,操作时间较长。 但中国脑机的65000个通道是一次性植入的。
2024-03-27 10:39:57 业内交流
-
结合高压冷冻的干超薄切片

①本文由仪器网入驻的作者或注册的会员撰写并发布,观点仅代表作者本人,不代表仪器网立场。若内容侵犯到您的合法权益,请及时告诉,我们立即通知作者,并马上删除。
②凡本网注明"来源:仪器网"的所有作品,版权均属于仪器网,转载时须经本网同意,并请注明仪器网(www.yiqi.com)。
③本网转载并注明来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
④若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi
- ACCSI2024,上海仪电科学仪器蝉联科学仪器行业多项奖项
- 【飞纳三点半】第 91 期直播通知:VSParticle 干法打印技术在电解水制氢催化剂中的应用
- 【内含福利】小鼠造模不用慌,MP饲料来帮忙!
- 新品上市 | 风传花信,SPINeasy血液核酸提取试剂盒已上市!
- 锂电行业 | 快速水份测定仪在锂电生产企业中的应用
- 新质检测和分析方案助力锂电新质生产力
- 天美公司-仪器信息网深度合作参与第十七届中国科学仪器发展年会ACCSI2024并斩获多项大奖
- 聚焦血管健康:深度探索与前沿对话——“血管稳态与疾病研究前沿会议”回顾
- 热点应用丨“小”花粉“大”奥秘—RMS1000带你解密花粉热(上)
- 农业新质生产力从生物育种开始
- 机械接触式测厚仪:一款精准测量厚度的神奇工具
- 电能质量监测装置在某单晶硅棒光伏产业基地的应用
- Q-6紫外分光光度计 | 环境监测的利器,助力绿色发展





