-

-
FL6000双调制叶绿素荧光测量仪


- 品牌:捷克PSI
- 型号: FL6000
- 产地:其它
- 供应商报价: 面议
-
北京易科泰生态技术有限公司
 更新时间:2024-04-26 10:43:07
更新时间:2024-04-26 10:43:07 -
企业性质生产商
入驻年限第9年
营业执照已审核
- 同类产品藻类叶绿素荧光测量技术(4件)
联系方式:刘经理13466520071
联系我们时请说明在仪器网(www.yiqi.com)上看到的!
-
为您推荐
- FL6000双调制叶绿素荧光测量仪 核心参数
- 详细介绍
FL6000双调制叶绿素荧光测量仪
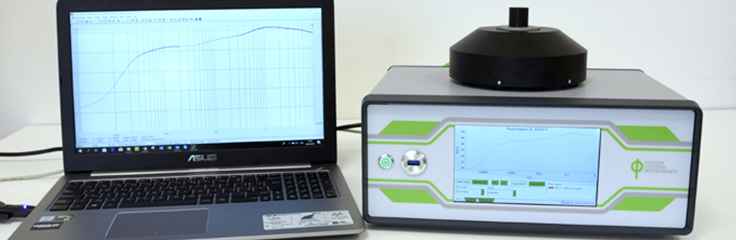
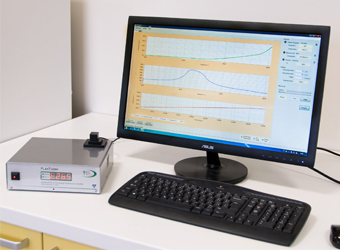
FL6000双调制叶绿素荧光仪是FL3500双调制叶绿素荧光仪的ZX升级版,专门用于对蓝绿藻或绿藻等微藻,叶绿体或类囊体悬浮物进行光合作用深入机理研究的强大科研工具。仪器具备双通道测量控制,可控制测量样品的温度,并配备单翻转光(STF),内置多种可用户自行修改的测量程序,可进行目前国际上对于叶绿素荧光的各种深入机理研究。其核心结构是包含了一个悬浮液标准样品杯的光学测量头,内置3组LED光源和1个1MHz/16位 AD 转换的PIN二极管信号检测器。AD转换的增益和积分时间可以通过软件控制。检测器测量叶绿素荧光信号的时间分辨率可高达4 µs(快速版为1µs)。
应用领域:
·植物光合特性和代谢紊乱筛选
·生物和非生物胁迫的检测
·植物抗胁迫能力或者易感性研究
·代谢混乱研究
·光合系统工作机理研究
·受胁迫植物光合生理应对策略研究

典型样品:
·蓝藻(蓝细菌)
·绿藻
·叶绿体悬浮物
·类囊体悬浮物
·植物碎片
功能特点:
·内置叶绿素荧光诱导测量、PAM(脉冲调制)测量、OJIP快速荧光动力学测量、QA–再氧化动力学、S状态转换、叶绿素荧光淬灭等测量程序,是世界上公认的功能为全面的叶绿素荧光仪
·双调制技术,可双色调制测量光,具备调制光化学光和持续光化学光,可进行STF(单周转光闪)、TTF(双周转光闪)和MTF(多周转光闪)及定制FRR技术(Fast Repetition Rate)测量
·标准版时间分辨率达4µs,快速版更高达1µs,是目前时间分辨率ZG的叶绿素荧光仪
·控制单元为双通道,可连接温度传感器用于温度控制、连接氧气测量单元用于希尔反应测量等
·具备极高灵敏度,ZD检测极限为100ng Chla/L
·测量光、光化光、饱和单反转光光源颜色、强度均可定制
·主机配备彩色触摸显示屏,可实时查看荧光曲线图
技术参数:
·实验程序:Kautsky叶绿素荧光诱导效应测量;PAM(脉冲调制)荧光淬灭动力学测量;OJIP快速荧光动力学测量;QA–再氧化动力学;S状态转换;快速叶绿素荧光诱导
荧光参数:
úPAM荧光淬灭动力学测量:测量荧光淬灭动力学曲线,可计算F0,Fm,Fv,F0’,Fm’,Fv’,QY(II),NPQ,ΦPSII,Fv/Fm,Fv’/Fm’,Rfd,qN,qP,ETR等50多项叶绿素荧光参数;
úOJIP快速荧光动力学测量:测量OJIP快速荧光动力学曲线,可计算F0、FJ、Fi、Fm、Fv、VJ、Vi、Fm / F0、Fv / F0、Fv / Fm、M0、Area、Fix Area、SM、SS、N、Phi_P0、Psi_0、Phi_E0、Phi_D0、Phi_Pav、ABS / RC、TR0 / RC、ET0 / RC、DI0 / RC等20多项相关参数;
úQA–再氧化动力学(QA- reoxidation kinetics):测量QA–再氧化动力学曲线,用于拟合QA–再氧化过程中快相(Fast phase)、中间相(Middle phase)和慢相(Slow phase)各自的振幅(A1,A2,A3)和时间常数(T1,T2,T3)
úS状态转换(S-state test):测量S-state test荧光衰减曲线,用于拟合计算无活性光系统II (PSIIX)反应中心数量
ú闪光荧光诱导(Flash Fluorescence Induction,FFL,仅限快速版):用于拟合计算有效天线面积、天线连通性等
ú提供用户自定义protocol功能,可实现PSII天线异质性PSIIα与PSIIβ分析、PSII有效天线截面积(s PSII)等参数的测量(选配定制功能)
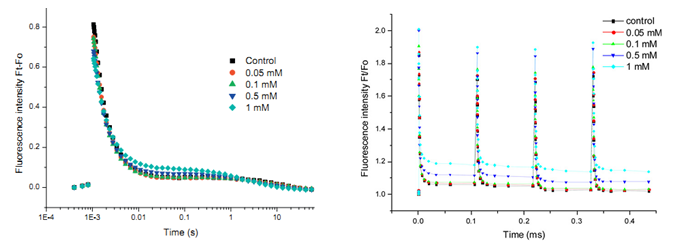
úQA–再氧化动力学曲线和S-state test荧光衰减曲线(Li,2010)
·时间分辨率(采样频率):高灵敏度检测器,标准版时间分辨率为4µs,快速版为1µs
·ZD检测极限:标准版100ng Chla/L,快速版1μg Chla/L
·控制单元:配备彩色触摸显示屏,可实时查看荧光曲线图
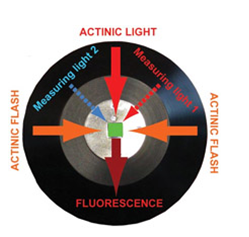
·测量室:
o测量光闪:623nm红橙光和460nm蓝光,光闪时间2–5µs
o单周转饱和光闪:ZD光强170000 µmol(photons)/m².s,光闪时间20–50µs
o持续光化学光:ZD光强3500 µmol(photons)/m².s
o荧光检测器:PIN光电二极管
oAD转换器:16bit
o样品试管:底面积10×10mm,容积4ml
定制测量室(选配):可分别定制测量光、饱和光闪和光化学光颜色(蓝色、青色、琥珀色等)以及检测波段(ChlA,ChlB)
远红外光源(选配):用于测量F0',波长730nm
·氧气测量模块(选配):测量藻类的氧气释放
·温度控制(选配):TR 6000温度调节器,控温范围5–60℃,精确度0.1℃
电磁搅拌(选配):用于样品混匀,防止样品沉淀,可手动调速或软件自动控制
通讯接口:RS232串口/USB
FluorWin软件:定义或创建实验方案、光源控制设置、数据输出、分析处理和图表显示
典型应用:
1. 中科院水生生物所王强研究员使用FL3500叶绿素荧光仪(FL6000之前型号)和TL植物热释光系统证明亚硝酸盐胁迫首先影响Synechocystis sp. PCC 6803 PSII受体侧(Zhan X, et al, 2017)。这种光合作用深入机理的研究经常需要这两种仪器来配合完成。
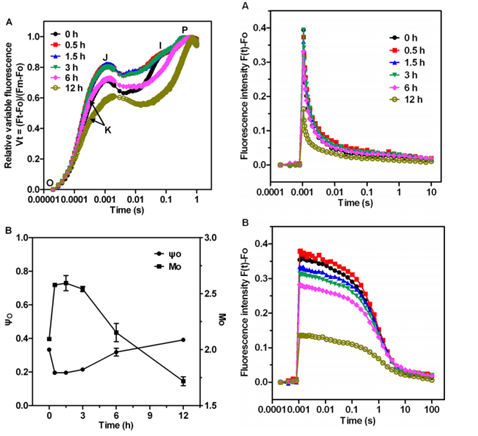
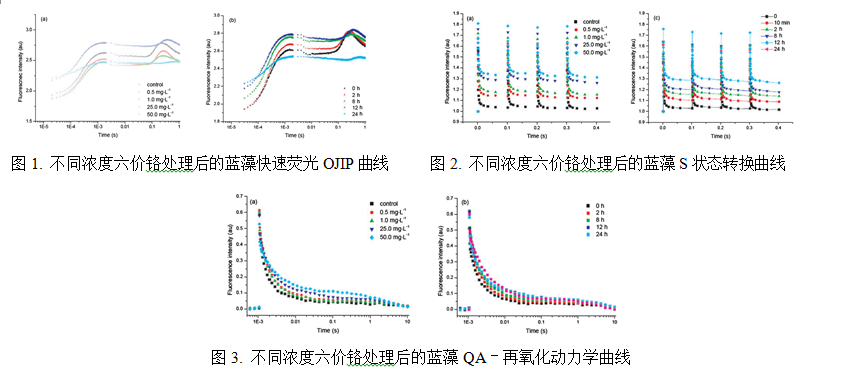
2.中科院新疆生态与地理研究所潘响亮研究员及其课题组使用FL3500叶绿素荧光仪(FL6000之前型号)深入开展了环境中重金属、盐分、有毒化合物、除草剂、杀虫剂、抗生素等各种有害物质对藻类的毒理研究。通过FL3500独有的高分辨率OJIP快速荧光动力学测量、QA–再氧化动力学、S状态转换等叶绿素荧光测量程序,全面揭示了不同浓度与处理时间对藻类光合系统造成损伤的毒理机制及其生态影响。目前,潘响亮课题组已经使用FL3500(FL6000之前型号)在国际SCI期刊与国内核心期刊上发表了二十余篇高水平文章。
产地:捷克
参考文献:
1. Manaa A, et al. 2019. Salinity tolerance of quinoa (Chenopodium quinoa Willd) as assessed by chloroplast ultrastructure and photosynthetic performance. Environmental and Experimental Botany 162: 103-114
2. Yu Z, et al. 2019. Sensitivity of Chlamydomonas reinhardtii to cadmium stress is associated with phototaxis. Environmental Science: Processes & Impacts 21: 1011-1020
3. Liang Y, et al. 2019. Molecular mechanisms of temperature acclimation and adaptation in marine diatoms. The ISME journal, DOI: 10.1038/s41396-019-0441-9
4. Orfanidis S, et al. 2019. Solving Nuisance Cyanobacteria Eutrophication Through Biotechnology. Applied Sciences 9(12): 2566
5. Sicora C I, et al. 2019. Regulation of PSII function in Cyanothece sp. ATCC 51142 during a light–dark cycle. Photosynthesis Research 139(1–3): 461–473
6. Smythers A L, et al. 2019. Characterizing the effect of Poast on Chlorella vulgaris, a non-target organism. Chemosphere 219: 704-712
7. Albanese P, et al. 2018. Thylakoid proteome modulation in pea plants grown at different irradiances: quantitative proteomic profiling in a non‐model organism aided by transcriptomic data integration. The Plant Journal 96(4): 786-800
8. Antal T, Konyukhov I, Volgusheva A, et al. 2018. Chlorophyll fluorescence induction and relaxation system for the continuous monitoring of photosynthetic capacity in photobioreactors. Physiol Plantarum. DOI: 10.1111/ppl.12693
9. Antal T K, Maslakov A, Yakovleva O V, et al. 2018.Simulation of chlorophyll fluorescence rise and decay kinetics, and P700-related absorbance changes by using a rule-based kinetic Monte-Carlo method. Photosynthesis Research. DOI:10.1007/s11120-018-0564-2
10.Biswas S, Eaton-Rye J J, et al. 2018. PsbY is required for prevention of photodamage to photosystem II in a PsbM-lacking mutant of Synechocystis sp. PCC 6803. Photosynthetica, 56(1), 200–209.
11.Bonisteel E M, et al. 2018. Strain specific differences in rates of Photosystem II repair in picocyanobacteria correlate to differences in FtsH protein levels and isoform expression patterns. PLoS ONE 13(12): e0209115.
12.Fang X, et al. 2018. Transcriptomic responses of the marine cyanobacterium Prochlorococcus to viral lysis products. Environmental Microbiology, doi: 10.1101/394122.
13.Kuthanová Trsková E, Belgio E, Yeates A M, et al. 2018. Antenna proton sensitivity determines photosynthetic light harvesting strategy, Journal of Experimental Botany 69(18): 4483-4493
| 适用环境: | 实验室 |