随着新冠疫情的防控,多地连日零新增。这离不开数以万计的YL工作者的贡献。同时,ZL药品和疫苗的开发效率不断彰显“ZG速度”。

国家药监局指出,要严格按照“安全守底线、LX有证据、质量能保证”要求,打破常规、特事特办,对符合疫情防控和诊疗所需的临床药物,开通绿色通道,提前介入指导,加快审评审批,确保尽早投入使用。对于通过应急审评审批程序获准注册的产品,加强上市后监督检查,保障产品安全可靠。
虽然国家开通了绿色通道,但抗病毒 药物的从实验室到临床的过程却一点也不简单。赛默飞色谱与质谱制药解决方案,助力药企与时间赛跑。
一、 研究开发
药物发现一般要经历靶点的发现及确认、先导,化合物的筛选与合成、活性化合物的验证与优化三个阶段。以抗体药为例,需要使用高分辨质谱(例如Orbitrap)用于单克隆抗体的结构表征,确证抗体分子结构,并筛选目标单克隆细胞群。完整分子量测定是抗体药研发中Z先进行的分析项目。

大家ZD关注的ZL性新冠特免血浆制品利用的就是康复的新冠病人体内产生了病毒中和抗体。如何发现中和抗体,制备出效果更好的单抗药物,高分辨质谱可以帮上忙。2012年美国CST公司,就已经利用蛋白质组学技术开发出人血浆中的抗乙肝病毒抗体,发表在NBT上。在药物研发和质量控制过程中,高分辨质谱在其理化性质的鉴定中成为必备的分析方法。
二、 临床前研究
临床前的研究准备包括制备工艺、制剂、检验方法、质量标准、稳定性、药理、毒理、动物药物代谢动力学研究。只有以上数据一应俱全,才能提交临床试验申请,开展临床试验。
其中,科学的建立药品的质量控制是保证药品安全有效的基础和前提。常规的检测项目和方法,依照《中华人民共和国药典》进行,通常不需要验证。例如卫健委针对新冠肺炎诊疗方案抗病毒推荐用药——利巴韦林之分析检测。药典中,利巴韦林注射液/片/颗粒/胶囊等品种都规定使用磺化交联的苯乙烯-二乙烯基苯共聚物为填充剂的强阳离子氢/钙/钠型交换柱。利巴韦林色谱峰理论板数16048(要求不低于2000)。以下是使用赛默飞HyperREZ XP H型色谱柱的实验色谱图。
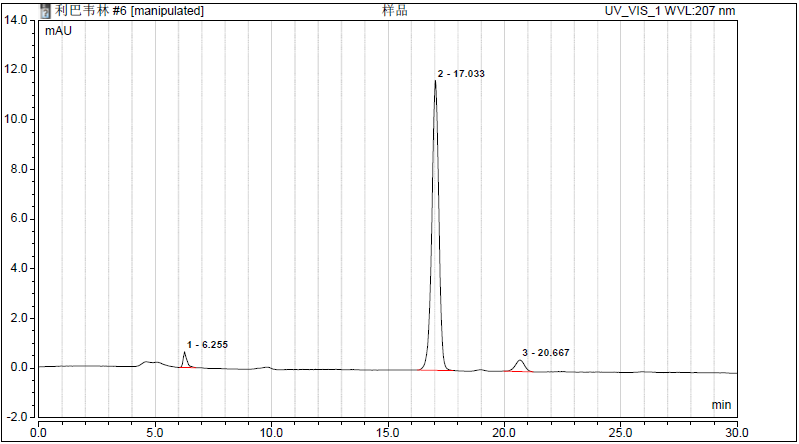
同时目前使用比较多的广谱类抗病毒 药物,紫外吸收差异大、极性分布广,使用药典推荐的电雾式检测(CAD),建立了多种抗病毒 药物同时分离分析的方法。在优化的条件下定量分析了5种抗病毒 药物,结果证明该方法具有较好的重复性,线性范围以及较高的灵敏度。

1. 泛昔洛韦;2. 金刚乙胺;3. 利巴韦林;4. 更昔洛韦;5伐昔洛韦
三、 临床试验
新药在进入人体开展临床试验之前需要向药品监督管理部门提出申请并获得批准。业内缩写为“IND”- Investigational New Drug Application,在我国称为“药物临床试验批件”申请。目的在于观测人体对新药的耐受程度和药代动力学,为制定给YF案提供依据。目前一些“老药”能否ZL新冠病毒,具体尚无明确结论。
临床试验获批之后,则开始临床试验,所有试验样品必须在cGMP条件下生产制备。人体试验分三期:
I期临床,主要进行安全性评价和药物在人体内的吸收、分布、代谢和排泄等研究。
II期临床,主要评价药物LX。
III期临床,目的是扩大样本量,通常为300-5000例患者,进一步评价并测定药物的LX以及不良反应。
临床实践中常常发现同样剂量的药物用于患同种疾病的不同病人,LX不同,毒副作用表现也不一样。这是因为存在着个体差异(年龄、性别、机体状况、遗传、种族等)。因此血药浓度监测尤为重要,药物作用的强度与药物在血浆中的浓度成正比,药物在体内的浓度随着时间而变化,LC-MS为监测血药浓度ZGX准确的手段。
抗病毒 药物根据作用机制,可分为穿入和脱壳YZ剂、DNA多聚酶YZ剂、逆转录酶YZ剂、蛋白质YZ剂、神经氨酸酶YZ剂、广谱抗病毒 药等。同时,临床上抗病毒ZL方案中,药物联用是重要的ZL手段之一。Transcend TLX1联合TSQ Altis提供的快速样本制备,对14种抗病毒化合物进行快速检测,为生物样本分析的时效性提供非常重要的技术支撑,用于临床药代动力学和ZL药物监测研究。
图中利匹韦林(rilpivirine)被选为本次新冠肺炎诊疗方案卫健委推荐用药。
四、 商品化生产
完成所有三阶段的临床试验并分析提交所有资料及数据,药物的安全性和有效性得到了证明,则可以向药监部门提交新药申请。新药申请一旦获得药监部门批准,便可以在cGMP标准的车间进行商品化的药品生产,正式上市销售,供医生和病人选择使用。
cGMP车间,数据合规则是diyi要务。新《药品管理法》对药企数据安全性提出了更高的要求。从研发到生产的数据管理系统,满足审计追踪,可以有效提升药企的运行效率,达到合规的需求。

赛默飞将竭尽所能为疫情防控提供支援,支持医药企业,无论是老药新用,还是开发创新药及疫苗,获得战“疫”胜利。
扫描下方二维码即可获取赛默飞全行业解决方案,或关注“赛默飞色谱与质谱ZG”公众hao,了解更多资讯+

让我们一起来学习检测实验室常见的仪器与耗材标准,实验室安全仪器标准,以及食品实验室标准。实验室常见的仪器与耗
食品微生物实验室的实验对象是致病微生物,所以操作过程中产生的废液、废气和废物中不可避免的带有致病微生物。因此
2019年10月23日,第十八届北京分析测试学术报告会暨展览会(BCEIA2019)在北京·国家会议ZX盛大
生物安全是人类生物危害(Biohazard)的定义为生物性的传染媒介通过直接感染或间接破坏环境而导致对人类、
为落实“十三五”国家药品安全规划任务,强化药品监管技术支撑,国家药监局组织完成了首批ZD实验室的评审工作,认
药物筛选过程中涉及大量RNA表达水平分析,但是一轮轮的qPCR检测遥遥无期,传统的RNA纯化-逆转录-qPC
实验室安全的话题总是老生常谈。实验室由于汇集各种危险物品,被挂名“不折不扣的事故高压锅”。有学者统计了200
8月21-23日,2019第二届中德智慧实验室高峰论坛将在辽宁盘锦隆重召开,本次论坛由健康报社主办、盘锦检验
7月31日,由河北省高等教育学会实验室工作分会主办的“2019年河北省实
实验室的仪器设备是直接用于提供检测结果或辅助检测进行的,是实验室的重要资产,也是重要的检测工具。对检测结果的