电解质溶液能够导电,遵守欧姆定律。在一定温度下,一定浓度的电解质溶液的电阻为

式中,R为电阻,Ω;ρ为电阻率,Ω·m;L为两个电极间的距离,cm;A为电极的面积,cm2。
电导定义为电阻的倒数,有
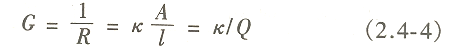
式中,G为电导,S;κ为电导率,S/cm,κ=1/ρ;Q为电导池常数,Q=L/A。
对电解质溶液的电导还与溶液中存在的离子的多少及性质有关。用摩尔电导的概念更能比较不同电解质溶液的电导能力。
摩尔电导是指相距1cm的两平行的大面积电极,放人含有1mol溶质的溶液的电导。有

式中,Am为摩尔电导率,S·m2/mol;cm为溶液中某物质的浓度,mol/L,需说明表示浓度的化学式单元,如NaCl、 ½K2S04、⅓LaCl3等 电解质的电导是由溶液内的正、负离子共同担的。强电解质的摩尔电导率是摩尔离子电导率的总和。
电解质的电导是由溶液内的正、负离子共同担的。强电解质的摩尔电导率是摩尔离子电导率的总和。有

式中,λ+、λ-分别为正、负离子的摩尔电导率。

式中,cmi为离子的摩尔浓度,mol/L;λi为离子的i摩尔电导率。
由于离子之间的相互作用,溶液的摩尔电导率随电解质浓度而改变。当溶液无限稀释时,λ+、λ-趋于极大值,用λ0+、λ0-表示,称为极限摩尔电导率。λ0表示离子在给定溶液无限稀释时的极限摩尔电导率,仅与温度有关,是各种电解质导电能力的特征常量。
离子的极限摩尔电导率的数据可用来计算电解质的极限摩尔电导率,以比较各种溶质的相对电导率,推断电导变化的趋势。
从理论确度讲,电导率是衡量水中含盐量的大小,电导率为电阻率的倒数,是表示水的导电能力的一项指标。因水中溶解的
prl化学发光分析法高多少不正常 化学发光分析法 化学发光(ChemiLuminescence ,简称
化学发光免疫分析法的原理 化学发光免疫分析原理 http://www.yhyg.com/articlev
光学分析法和光谱分析法主要区别是什么?请附注资料来源 光学分析法 主要根据物质发射,吸收电磁辐射以及物质
在我们生活学习和工作中如何运用矛盾分析法去解决实际问题:1.首先结合具体实例2.什么叫矛盾分析法,范围广泛
什么是恒波长同步荧光分析法,与常规荧光分析法有什么区别与不同?Z好能提供一点相关文献,免费的~ 荧光分析法 荧
化学发光微粒子免疫分析法可以确诊梅毒螺旋体的确认试验吗 梅毒它主要是性感染的性疾病,其通常侵犯患者皮肤、
普通电解分析法的实验条件是什么?极谱分析法的实验条件是什么?为什么说极谱法是特殊的电解形式? 首先Z关键的
极谱分析法在日常生活中有什么作用? 这问题微专业了! 极谱分析法诞生于1925年,但是在短短的几十年里,
简述电位分析法的原理,分类及应用 电化学分析法 电位分析法 直接电位法 电位滴定法 库仑分析法 控制电