我们的世界物种多种多样,而与我们人类生存关系最密切的就是植物。随着时间的推移与科技的进步,人类在逐步揭示自身基因真相的同时,也在不断探寻植物基因的种种功能。其中,蛋白质是植物生命活动的主要承担者。因此,在植物学相关研究中,蛋白质之间的相互作用是研究的重要基础和手段。
目前,研究蛋白质-蛋白质相互作用常用方法主要包括:酵母双杂交技术 (Yeast Two-hybrid, Y2H)、双分子荧光互补技术(Bimolecular Fluorescence Complementation, BiFC)、免疫共沉淀技术(Co-Immunoprecipitation, CoIP)及荧光共振能量转移技术(Fluorescence Resonance Energy Transfer, FRET)等,以及近几年来逐步应用到的萤火虫荧光素酶互补技术(Firefly luciferase complementation imaging assay, LCI)。
面对众多的技术,您是否也苦恼过,到底哪种技术更加适合我的实验呢?要选择哪些技术相互搭配才更加高效呢?面对这一连串的疑问,不要惊慌,今天小编准备了一篇技术简报,一起了解一下各类蛋白互作技术。
酵母双杂交技术(Y2H)
酵母双杂交技术是将待研究的两种蛋白质分别克隆(融合)到酵母表达质粒的转录激活因子的DNA结合结构域(DNA-BD)和转录激活域(AD)上,通过2 个结构域的结合,从而调控目的基因的转录过程。这两个结构域分开时仍分别具有功能,但不能激活转录,只有当被分开的两者通过适当的途径在空间上较为接近时,才能重新呈现完整的转录因子活性,并可激活上游激活序列(upstream activating sequence,UAS)的下游启动子,使启动子下游基因得到转录。

优点:
① 操作简单,方便快捷,实验成本较低;
② 可快速、大量筛选蛋白互作组;
③ 灵敏度高,可检测存在于微弱或暂时蛋白相互作用。
缺点:
① 自身转录蛋白往往会造成假阳性的结果;
② 蛋白过量表达时对酵母产生毒性,使得酵母无法正常生长;
③ 无法检测细胞核外的蛋白互作。
双分子荧光互补技术(BiFC)
双分子荧光互补技术本质上是一种蛋白质片段互补技术,是指将荧光蛋白多肽链切开并形成不发荧光的 N-和 C-末端2个多肽片段。当目标蛋白质相互作用时,2个片段重新构建成完整的具有活性的荧光蛋白分子,即可产生荧光。
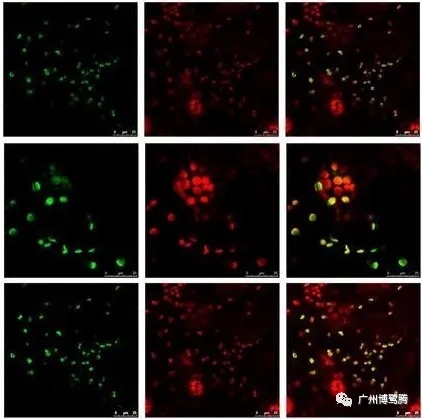
优点:
① 灵敏度高,直观可视;
② 可以对在动物、植物和细菌等不同的宿主细胞中蛋白进行定位和互作强度分析;
③ YFP,RFP等荧光标记选择多样。
缺点:
① 对温度条件要求较高,温度越低,越有利于片段之间的互补;
② 有时2个不发光的荧光片段会发生自发融合的情况,出现假阳性的结果。
免疫共沉淀技术(CoIP)
借助抗体和抗原之间的专一性,确定两种蛋白质在完整细胞内生理性的相互作用。当用预先固化在argarose beads上的蛋白质A的抗体免疫沉淀A蛋白,那么与A蛋白在体内结合的蛋白质B也能一起沉淀下来。再通过蛋白变性分离,对B蛋白进行检测,进而证明两者间的相互作用。
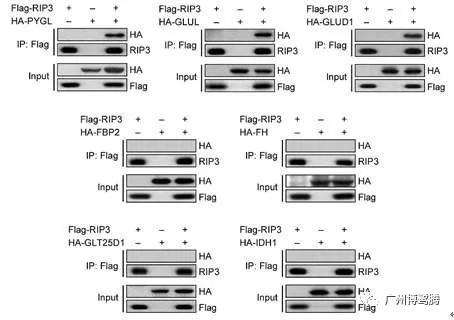
优点:
① 常被用于鉴定特定蛋白复合物中未知的蛋白组分;
② 可分离得到天然状态的相互作用蛋白复合物。
缺点:
① 可能检测不到低亲和力和瞬间的蛋白互作;
② 两种蛋白质的结合可能不是直接结合,而可能有第三者在中间起桥梁作用,也可能出现假阳性的结果;
③ 对抗体选择和实验者操作技术要求较高。
荧光共振能量转移技术(FRET)
基于两个荧光基团间能量通过偶极-偶极耦合作用以非辐射方式从供体传递给受体的现象,可用于测定分子间的距离。在两个不同的荧光基团中,如果一个荧光基团(供体 Donor)的发射光谱与另一个基团(受体 Acceptor)的吸收光谱有一定的重叠,当这两个荧光基团间的距离合适时(一般小于100Å),就可观察到荧光能量由供体向受体转移的现象,即以前一种基团的激发波长激发时,可观察到后一个基团发射的荧光。
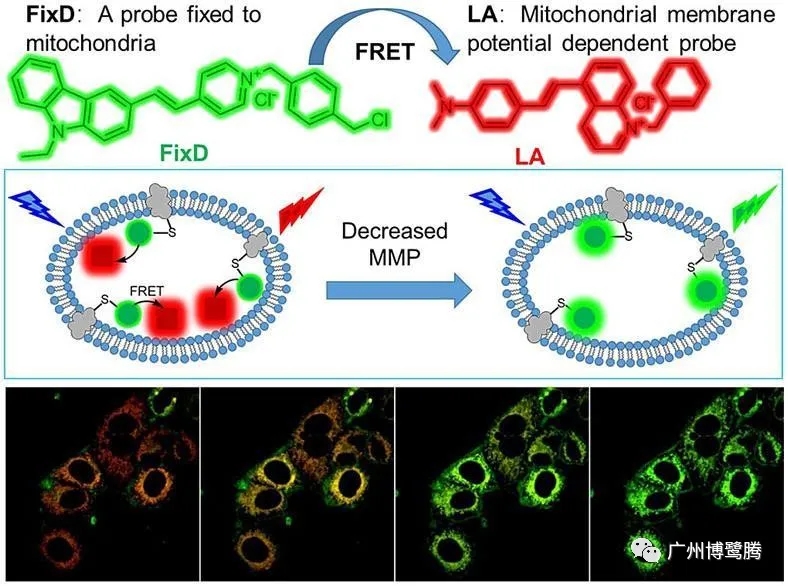
优点:
① 适用于活细胞和固定细胞的各类分子,
② 灵敏度更高,成像更清晰,最直观地提供蛋白质相互作用的定位和定量信息。
缺点:
① 能量供体与能量受体的光谱、排列方式、量子产率、消光系数、水溶性、抗干扰能力等方面要求较高。
② 需要更加精密的仪器,技术难度更高,操作更复杂。
荧光素酶互补法(LCI)
最初开发用于检测哺乳动物活细胞中的蛋白质-蛋白质相互作用,但后来被用于植物的研究中。借助于烟草的瞬时表达系统,将含有融合蛋白的表达载体转化农杆菌后注射烟草叶片,培养2-3天后,在注射部位均匀涂抹反应底物。通过植物活体成像系统和高灵敏度发光检测仪检测生物发光的强度,从而对蛋白之间的相互作用进行定性和定量分析。此方法已被广泛应用于动植物相关领域的蛋白质互作研究。
原理:将荧光素酶蛋白分为N端和C端2个功能片段, 即NLuc和CLuc。待测的2个目的蛋白分别与NLuc和CLuc融合。当2个目标蛋白相互作用将NLuc和CLuc紧密结合,恢复荧光素酶的催化活性,促使荧光素酶底物氧化而发光。
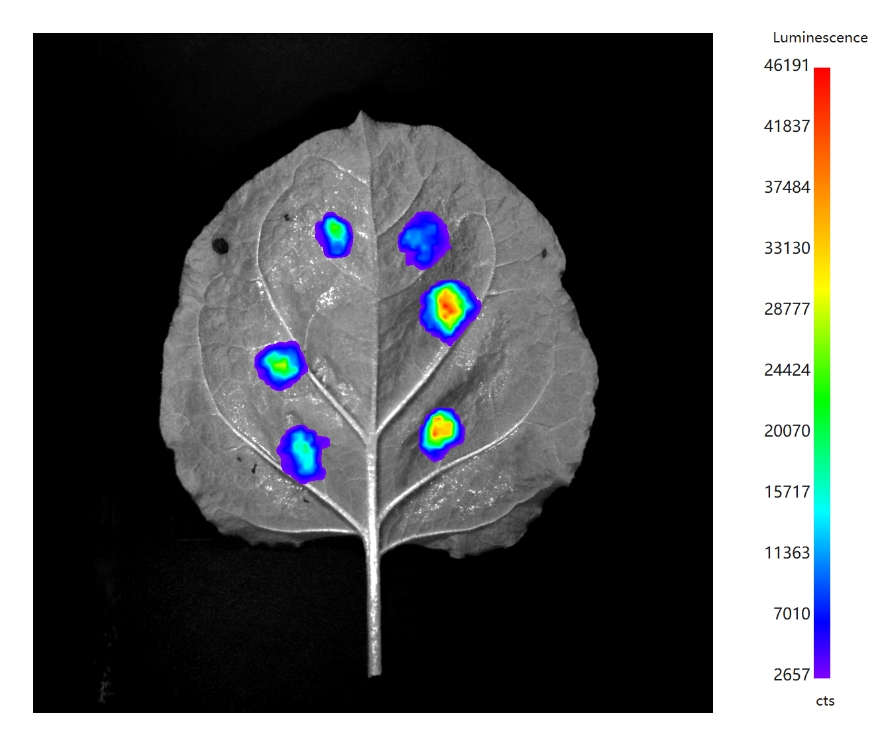

优点:
① 高度定量,允许在几个数量级的范围内对发光信号进行线性测量。
② 与FRET和BiFC相比,此法可对整个组织或细胞群进行采样,避免了来自单个细胞的偏差。
③ 在黑暗中测量发光,不受叶绿素和细胞壁产生的自荧光的影响。
④ 可用于在组织水平上研究蛋白质-蛋白质相互作用,该技术对于研究组织特异性蛋白质-蛋白质相互作用非常有用。
⑤ 无需显微镜,通过使用植物活体成像系统和板式发光检测仪可以在1-2分钟内收集数据,进行定性和定量分析,同时检测大量的蛋白质组。
⑥ 需要最少的样品处理和实验室培训,操作简便,实验高效。
⑦ LCI作为植物蛋白质相互作用研究的简单工具的可用性将有助于验证从酵母双杂交分析中收集的蛋白质相互作用组数据。
⑧ 实验周期更短,实验从零开始,只需1-2个月便可得到稳定的实验结果。
实验方法
① 分别将待测蛋白质的基因克隆到含有CLuc和NLuc编码序列的质粒中,然后将所得质粒转入农杆菌中。
② 将含有这两种质粒的农杆菌细菌浸入本氏烟草中,以便重组DNA可以被传递到植物细胞中并稳定表达。
③ 收集表达测试蛋白质的叶组织,通过植物活体成像系统和高灵敏度发光检测仪检测生物发光的强度,从而对蛋白之间的相互作用进行定性和定量分析。
技术总结
上述5种技术中应用最广泛的是Y2H,它可以大规模筛选相互作用的蛋白对,然而,其检测有一定的假阳性率和局限性。CoIP则需要特定抗体,受如蛋白质提取、结合和洗涤方案等实验操作影响较大,使得每个实验室的结果往往是不同的。FRET分析技术都需要精密的显微镜和计算,在植物上的应用依旧困难重重。与FRET相比,BiFC相对简单,已用于许多植物蛋白质-蛋白质相互作用研究,但由于细胞壁、叶绿体和其他细胞结构产生的自荧光,FRET和BiFC分析在植物中的应用与检测方法变得十分复杂。此外,由外部光源激发荧光引发的干扰,也使其在植物中的应用受限。
因此,采用荧光素酶互补法就具有重要意义。萤火虫荧光素酶的氨基末端和羧基末端只有在融合到两个相互作用的蛋白质上时才能重建活性荧光素酶,可使用植物活体成像系统来进行观测。其技术简便、可靠、灵敏度高、定量,并已获得很多文献的支持,可用于相互作用蛋白的瞬时表达或稳定的转基因表达。

请问:怎样知道某种植物蛋白质的等电点?如能从实验中得出,请通俗的加以解释其方法(抱歉因对此项不是特别内行,
请问如何从植物蛋白水解液(使用蛋白酶水解)中提取复合氨基酸,哪位知道请给一个详细的流程图,要详细点的。方法
蛋白质组学技术已经成为植物科学研究中重要的工具,以Orbitrap为代表的高分辨质谱技术已在植物蛋白质研究领
水解酪蛋白(CH)在植物组培中的一般使用量为多少?是500mg/L吗?水解酪蛋白与酸水解酪蛋白是一样的吗?
求助:植物蛋白的分离和电泳方法 植物组织蛋白质提取方法 1、根据样品重量(1g样品加入3.5ml提取液,可根
列举。 《常见食物蛋白含量表》 食物名称 每100克食物含蛋白质 燕麦 15.6 莲子 16.6 黄豆
大部分蛋白是可以室温干燥的,因为有机溶剂挥发很快,室温干燥花不了多少时间,蛋白质来不及变性。如果想再快一点,
蛋白质纯化RP-HPLC 是一种有效的蛋白质/多肽纯化工具。 通过 RP-HPLC 法可以从杂质中分离目标蛋白/多肽
蛋白质组学 蛋白质组学是鉴定和定量细胞、组织或生物体蛋白质的科学,目的是了解生物学变化和疾病状态,开发疾病的生
微生物细胞培养,简称微生物培养,包括原核细胞培养(细菌培养)和真核细胞培养(霉菌培养和酵母培养)。这些细胞小