为了规范皮肤和黏膜用半固体制剂的体外释放试验,世界中医药学会联合会经皮给药专业委员会组织专家多次研讨,历时两年多,基于国际的要求和国内的实际,形成了本专家共识,供业界同行及监管部门参考。

以下为共识全文:
关键词:体外释放试验;半固体制剂;质量评价与控制;专家共识
中图分类号:R943文献标志码:B 文章编号:1007-7693(2022)20-2707-10
DOI: 10.13748/j.cnki.issn1007-7693.2022.20.020
引用本文:世界中医药学会联合会经皮给药专业委员会. 皮肤和黏膜用半固体制剂体外释放试验技术规范专家共识[J]. 中 国现代应用药学, 2022, 39(20): 2707-2716.
药物从制剂中释放是发挥疗 效的第 一步,体外释放试验(in vitro release test,IVRT)虽然不能很好 地反映外用半固体制剂中药物与皮肤间的相互作用,但实验结果对制剂的组成、物理性能、微观结构与工艺变化敏感,可以作为半固体制剂质量评价与控制的手段。尽管国家药品监管部门已颁发了一些有关半固体制剂研究工作的指南,但IVRT技术仍需规范[1-3]。为了规范皮肤和黏膜用半固体制剂的IVRT,有必要对操作细则进行科学描述。因此,世界中医药学会联合会经皮给药专业委员会组织专家多次研讨,基于国际的要求和国内的实际,结合专家的经验,形成了本专家共识,旨在为皮肤和黏膜用半固体制剂IVRT的研究方法提供建议。
1 技术原理与应用
1.1 IVRT 技术原理
半固体制剂应用在皮肤或黏膜上,活性成分先从制剂基质中释放到达皮肤或黏膜表面,一些药物可直接在表面发挥作用,大多药物需通过扩散或渗透进入皮肤或黏膜产生作用,或继而被毛细血管吸收进入体循环而产生药效。药物的释放性能是影响药效的关键因素,而 IVRT可以区分由半固体制剂的细微改变引起的药物释放特性变化。药物从半固体制剂基质中的释放一般遵循Fick’s扩散定律,Higuchi认为在一定条件下(如药物在基质中的扩散系数恒定,可以足够快地从基质中转运到接受介质,并在接受介质中保持漏槽条件,基质不会膨胀或溶解等) [4],可以将复杂的扩散过程用以下简单公式表示:
当药物是溶解在基质中时:
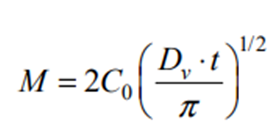
当药物是混悬在基质中时:
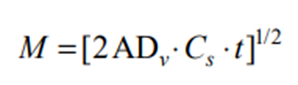
式中M是时间为t 时的累积释放量,C0是初始药物浓度,Dv药物在基质中的扩散系数,A是混悬型制剂的药物浓度,Cs是药物的溶解度。上述二式都可以简化为M=kt1/2,即药物的累积释放量与时间的平方根成正比,直线的斜率即为药物的体外释放速率(in vitro release rates,IVRR),它取决于药物的性质、制剂的组分及制剂的微观结构和理化性质。应用此公式计算IVRR时,药物从基质中释放的累积量一般应≤30%。然而半固体制剂基质种类 多,在某些基质中药物的释放机制并不仅仅是扩散,释放行为不能满足Higuchi假设条件,此时可用其他数学模型拟合释放曲线[5-6]。
1.1 IVRT 的应用
本共识中主要讨论IVRT用于监测和表征药物从软膏剂、乳膏剂、凝胶剂等半固体剂型中的释放特性。半固体制剂的体外IVRT可以反映药物的溶解度、粒径、制剂的微观结构与流变学性质等各种理化参数的综合作用。IVRT可用于:①表征制剂释放药物的性能,用于制剂的处 方设计与优化;②可用作质量控制方法,以确保批次间产品质量。用于评估放大和批准后变更后的产品等同性;③用作制剂稳定性考察的质量指标;④评估制剂处 方组成和制造工艺的变化、设备与生产场所的改变对产品质量的影响;⑤评估仿制药与参比制剂之间的等同性,是仿制药的生物豁免的依据之一。
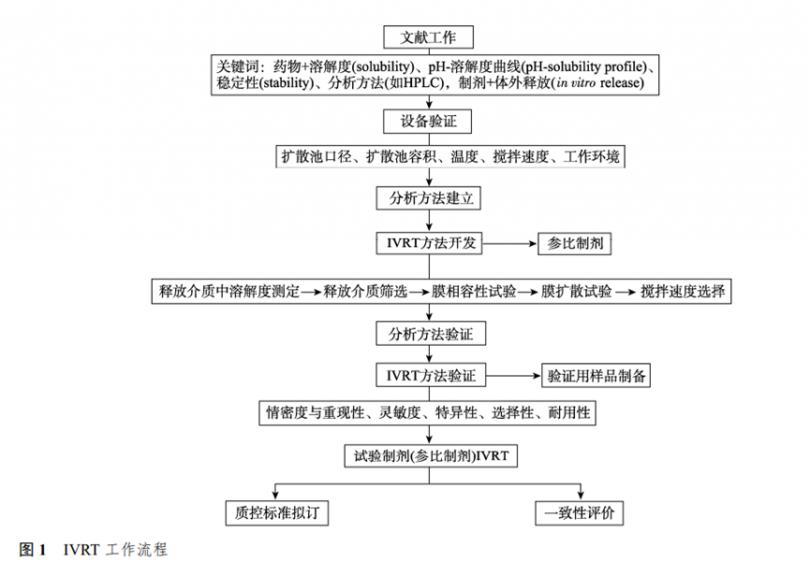
2 IVRT工作流程
IVRT工作流程见图1。
3 扩散池[3]
扩散池是 IVRT 的重要装置,选择合适扩散池有助于试验结果的稳定和可靠。
3.1 立式扩散池
立式扩散池由供应室和接受室及维持扩散池温度的水夹层或干热恒温系统组成,亦有将扩散池浸入开放式恒温水浴中,供应室置于吃水线上方。供应室和接受室之间由合成膜隔开,供应室与膜之间可装有定量环,并通过夹具固定在一起。供试样品加于供应室中或填充在定量环中,接受室有取样的支管和混合溶液的磁搅拌棒,见图2。接受室也可连接自动取样装置,定时自动取样。
立式扩散池的形状与大小可以根据需要设计。对于IVRR小的制剂,可用有效扩散面积与接受室容积比值大的扩散池,可提高接受介质中药物浓度,有利于药物浓度的检测。对于 IVRR大的制剂,可用有效扩散面积与接受室容积比值小的扩散池,有利于接受室中维持药物浓度的漏槽条件。立式扩散池设计时,一个经常被忽略的关键工作是以流体动力学检测搅拌效率。
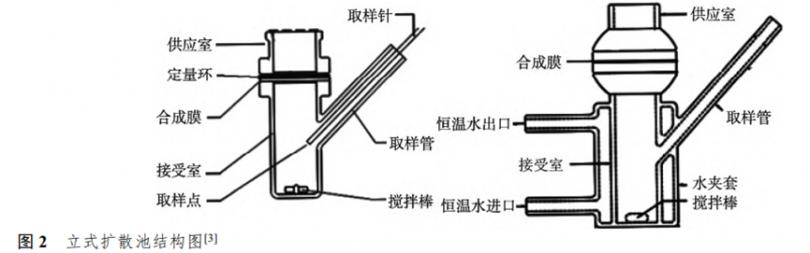
同一组扩散池的几何形状和大小应相同。扩散池口径与接受室容量的误差应在±5%内。加有搅拌棒的接受室充水后称重,计算接受室容量。定量环根据装量大小有各种厚度,常用 1.5mm,允许误差是±10%,各扩散池的口径及取样管与接受室的夹角应一致。接受室中的磁搅拌棒可有各种形状,但同一组扩散池中搅拌棒的形状与大小需相同。
立式扩散池法使用简便、重现好,适用于自动化,最 为常用。因此,下文讨论IVRT研究方法与操作要点时,主要以立式扩散池为例。
3.2 浸池法
浸池法的装置与溶出仪配套使用,由固定环、膜和样品室组成,配有特定的溶出杯和小搅拌桨,见图3。固定环将膜固定到样品室上,并确保与样品完全接触;在膜、固定环和样品室之间有防漏密封的垫圈;样品室有一个调节板可以改变样品室的体积。典型样品室表面积为4cm2,样品装量为0.3~2g,常用的溶出杯为200 mL。浸池与溶出装置(桨法)配合使用,用特定的小桨更换标准桨。在装载样品室放入容器之前,设置桨的高度在膜表面上方(1.0±0.2)cm。将被测样品填充样品室,确保样品室被注满至顶部,借助抹刀可以获得均匀的表面。使用镊子从浸泡介质中取出膜,并将其放在储药室的顶部。确保膜没有皱纹,样品表面和膜之间没有气泡,按照设备制造商的规定组装。小心地将完成的组件放入溶出仪的溶出杯底部,然后加入预热[(32.0±0.5)℃或(37.0±0.5)℃]的释放介质开始测试。

浸池法的优点是具有大的释放表面积,使用方便,耐用、降低气泡存在的可能性及容易实现 漏槽条件,前提是实验室已经配备了溶出仪。
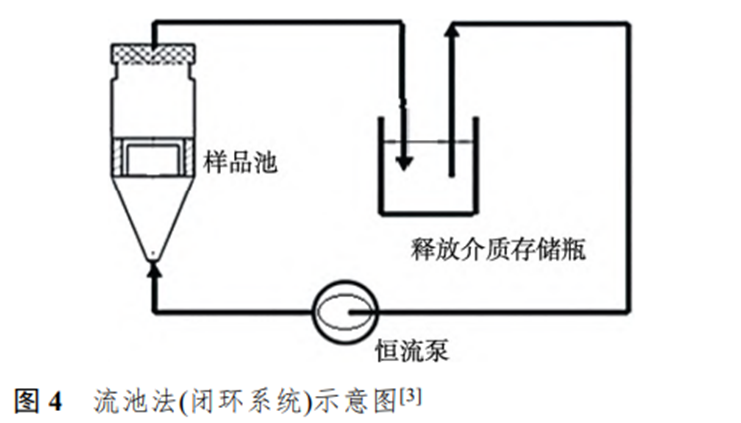
3.3 流池法
流池法由释放介质存储瓶、恒流泵、样品适 配器、恒温水浴、滤器和释放介质收集器组成。样品适配器由样品池和固定膜的环组成,样品池大小可供选择。根据释放介质流通方式不同,流池法可分为闭环系统和开环系统。闭环系统中样品装于样品池中,恒流泵将释放介质泵入样品池的下端,释放介质与样品接触后经滤器过滤后,回到释放介质存储瓶,再进行循环,见图4。开环系统与闭环系统的区别是释放介质经过样品池后不流回到释放介质存储瓶中,测试样品始终接触新鲜的释放介质,可保证维持漏槽条件。流池法与立式扩散池相比,它在膜界面处不易形成气泡,适合难溶性药物的IVRT。
4 IVRT 的方法开发
4.1 药物分析方法的建立
释放介质中药物定量分析方法可基于制剂质量标准中的药物分析方法,常需提高灵敏度,使其能定量分析接受介质中低浓度药物。此外,应充分评估该方法的专属性,避免制剂中辅料成分对药物测定的干扰。对于含量低的药物制剂,还应注意实验过程中仪器及用具对药物的吸附作用。
4.2 接受介质
接受介质的选择是IVRT方法研发过程中最 关键的因素之一,应根据药物和制剂的物理化学性质选择接收介质。筛选接受介质时应考虑以下因素:
①接受介质中药物的溶解度:制剂中药物的IVRR不应受到药物在接受介质中溶解度的影响,即接受介质应符合漏槽条件。药物的溶解度应是实验过程中药物在接受介质中最 大浓度的3倍以上,较高的要求是10倍。对于含难溶性药物的制剂,可选择一定浓度的有机溶剂或加入一定浓度的表面活性剂[7],常采用的有乙醇、异丙醇、聚乙二醇 400、聚山梨酯 80、十二烷基硫酸钠等。如使用表面活性剂作增溶剂,操作过程中应注意产生的泡沫,在接受室中形成气泡,滞留在膜的下表面,干扰接受介质与膜的接触,影响药物的释放,所以应尽量避免使用。药物溶解度随pH变化时,根据pH溶解度曲线,选择一定pH的缓冲溶液作接受介质,增加药物溶解度。含有机溶剂或 表面活性剂的接受介质,需注意对制剂辅料的溶解作用而对释放试验产生干扰。有机溶剂溶液宜当天制备使用,以免对有机溶剂浓度高度敏感的药物引入实验结果误差[8]。
②药物在接受介质中的稳定性:接受介质中的药物在实验期间及样品待分析的储存期间(对温度、光线)应稳定,稳定性受pH影响的药物,宜选用一定 pH 值的缓冲液作接受介质,实验过程中 保持恒定的 pH 值。
③接受介质的反向渗透:凝胶剂和乳膏剂等在IVRT过程中,常发生接受介质的反向渗透。应尽量减少接受介质的反向渗透,以避免实验过程中制剂物理性能的改变。反向渗透常发生在水溶性聚合物组成的凝胶剂中,供应室中的凝胶制剂和接受介质之间的渗透压差很可能导致水从接受室渗透至供应室,导致凝胶制剂溶胀。凝胶制剂的药物IVRR将受到2个相反参数的影响,即通过凝胶的药物扩散速率增加和凝胶中药物浓度降低。反向渗透发生时, 凝胶被水稀释,凝胶黏度降低,从而提高药物分子的扩散速率。另一方面,随着凝胶的膨胀药物浓度的降低,药物从供应室中向接受室扩散的驱动力减小。因此,IVRR的变化将取决于这2个相反的参数如何平衡[9]。可在接受介质中加入渗透压调节剂(如糖与盐),抑 制接受介质的反向渗透。人工汗液可抑 制某些凝胶制剂的反向渗透,其组成可以是NaCl 2.92 g·L−1、CaCl2 0.166 g·L−1、MgSO4 0.12 g·L−1和 KH2PO4 1.02 g·L−1,调节pH至5.4。凝胶剂的处 方不一,有些凝胶剂需要高离子强度与低pH的模拟液才能抑 制接受介质的反渗透,如 NaCl 5.49 g·L−1、CaCl2 3.32 g·L−1、MgSO4 0.24 g·L−1、和KH2PO4 1.36 g·L−1,调节pH 至4.5[10]。使用这些模拟液时需考察对药物溶解度的影响及相互作用。
④接受介质不干扰药物浓度测定:接受介质应不干扰药物浓度的测定。如当药物含量低且IVRR小时,可能需要采用液质联用分析方法,因样品中不能含有非挥发性的盐,磷酸盐缓冲液和柠檬酸盐缓冲液等就不适宜作接受介质。
黏膜用半固体制剂的应用环境与皮肤用半固体制剂不一样,大部分黏膜用制剂释放后直接作用于靶部位。虽然IVRT主要目的是验证产品质量的一致性,但IVRT条件模拟体内环境将有助于预测制剂在体内释放。建立黏膜用半固体制剂IVRT方法时,需考虑应用环境的相关生理参数,如 pH、缓冲容量、渗透压、离子强度、黏度和表面张力等,常见的模拟体液有人工泪液、人工唾液、人工阴道液。人工泪液:NaCl 6.78 g·L−1、NaHCO3 2.18 g·L−1、CaCl2·2H2O 0.084 g·L−1、KCl 1.38 g·L−1,调节 pH 值至 7.4[11]。人工唾液:KCl 0.72 g·L−1、CaCl2·2H2O 0.22 g·L−1、NaCl 0.60 g·L−1、KH2PO4 0.68 g·L−1、Na2HPO4·12H2O 0.856 g·L−1、KHCO3 1.500 g·L−1、硫氰酸钾 0.060 g·L−1、柠檬酸0.030 g·L−1,调节pH值至 6.5[12]。人工阴道液:NaCl 3.51 g·L−1、KOH 1.40 g·L−1、Ca(OH)2 0.222 g·L−1、BSA 0.018 g·L−1、乳酸 2.00 g·L−1、醋酸1.00 g·L−1、甘油0.16 g·L−1、尿素0.40 g·L−1、葡萄糖 5.00 g·L−1,调节pH值至4.2[13]。
IVRT时如接受室中形成气泡,聚集在膜界面,减少药物释放的有效表面积,使IVRR的降低,而使实验结果导入误差,因此接受介质脱气是必要操作步骤。接受介质中含挥发性有机溶剂,容易产生气泡,脱气时应注意防止溶剂的挥发而引起接受介质组成的改变。建议考察>3种的候选接受介质,于32℃测定药物的溶解度后,用参比制剂进行IVRT,每次平行3 份。筛选得的接受介质应在方法学验证中具有合适的选择性。浸池法中接受介质的量常用为 100 mL或200 mL。
4.3 合成膜
合成膜覆盖在接受室口,将供应室和接受室分隔开,支撑供应室样品进行释放实验,药物渗透合成膜进入接受介质。常用的合成膜有硝酸纤 维素膜、醋酸纤维素膜、混合纤维素酯膜、聚砜膜、尼龙膜、聚醚砜膜、聚四氟乙烯膜、聚偏氟乙烯膜和聚碳酸酯膜等。
4.3.1 合成膜选择原则 ①物理化学惰性,与制剂不应有物理或化学相互作用;②具有高渗透性,对药物渗透屏障作用小;③膜的物理完整性不受接受介质或制剂处 方的影响;④质量稳定、批间差异小。
4.3.2 膜物理参数选择 ①理想的膜是具高孔隙率和厚度小,常用膜厚度为70 μm;②膜孔径一般为(0.5±0.3)μm,常为0.45μm;③膜孔径的选择需考虑制剂基质的亲水与疏水性,如油脂性基质可选大孔径膜;④膜孔径的选择应考虑制剂的稠度与接受介质反向渗透的可能性。4.3.3 膜惰性试验建议选择>3种候选膜进行筛选。用接受介质筛选时,测试结束时接受介质中药物的平均浓度对膜进行吸附试验。参照接受室容积,将膜置于含药物接受介质中,一式 3份,于(32±1)℃恒温振荡,持续至释放实验所需时间,实验需用无膜溶液作对照,结束时测定药物浓度。含膜样品的平均浓度与对照溶液平均浓度之比> 95%,则认为该膜是惰性的[14]。IVRT方法验证中精密度测定结束时接受介质中药物的平均浓度如小于以上浓度,还需以此浓度进行膜惰性验证。对于眼表给药、直肠或阴道给药的半固体制剂,应分别采用(35±1)℃或(37±1)℃进行试验。
4.3.4 膜的筛选 各种膜的结构与表面性能不一样,通过膜惰性试验的膜,还要进一步筛选。取> 3种候选膜进行IVRT,每一种膜用参比制剂,在> 3个扩散池中进行试验,考察膜的适用性。不同供应商的相同膜可能会产生不同的释放曲线,因此还应考虑供应商之间的差异[15]。为了考察膜对不同IVRR制剂的分辩能力,其后还需进一步验证。
4.3.5 膜的使用 在使用前膜需在接受介质中浸泡>30 min,亦可用超声波处理,促进膜孔中空气的逸出。为保持膜的柔软性,纤维素衍生物膜常含有甘油等增塑剂,在使用前需用水洗去。
4.4 温度与搅拌速度
4.4.1 温度 温度变化能引起药物的扩散系数变化,亦能引起半固体制剂流变学性质(尤其温敏性制剂)改变。IVRT中膜表面温度要维持在(32±1)℃, 实验前后用非接触式高精度红外测温仪测温,使用前需校准,使用时避免环境的影响。另外,一些黏膜用半固体制剂,由于应用环境与皮肤不一样,膜表面维持温度各有差异。如眼表给药采用(35±1)℃,直肠或阴道给药采用(37±1)℃。
4.4.2 搅拌速度 试验期间接受室内的搅拌棒使接受介质充分混合,以确保膜下方的药物浓度与接受室整体及采样部位药物浓度相同。如果搅拌速度过小,可导致膜表面局部偏离漏槽条件,接受介质中的药物浓度可能不均匀,使采样不准确。搅拌速度太大可能产生涡流,能使膜变形,给测试结果带来误差。在USP标准的立式扩散池中, 搅拌速度常为600 r·min−1,误差为±10%。不同的扩散池,由于整体结构与搅拌棒几何形状不同,各有不同的适宜搅拌速度[8]。搅拌棒的搅拌效率还与接受介质黏度等有关。适宜的搅拌速度使接受介质快速混合均匀,而又不产生涡流,需要样品通过不同搅拌速度进行IVRT筛选,并最 后通过IVRT方法学验证。浸池法中搅拌桨的转速需优化,常有25,50,100 r·min−1。搅拌桨高度可在膜表面上方 1cm或2.5cm。在流池法中,释放介质流速是的重要参数,确定释放介质的最 佳流速有利于准确评估IVRR。流速过慢,IVRR可能会因释放界面丧失漏槽条件而受抑 制,通常在 16~24 mL·min−1,误差允许范围为±5%[3]。对于开环式流池法,流速过快可能导致药物浓度过度稀释,不利于药物浓度准确测定。需要根据药物在释放介质中的溶解度、药物的释放性能、有效释放面积、分析方法灵敏度等选用适宜的释放介质用量和流速。
5 分析方法的验证
IVRT 接受介质中药物浓度测定常用HPLC,样品分析方法验证应遵照相关的分析方法验证指导原则[16],按常规进行方法学验证,包括专属性、精密度、准确度、线性范围、检测限和定量限、系统适用性和稳定性等评估。
6 实验设计
IVRT是先在扩散池的接受室充填了接受介质,于预先在接受介质中浸泡>30min的膜上,加测试样品,保持恒定温度与一定的搅拌速度,在预定时间点抽取接受介质测定药物浓度,同时补充同量同温的新接受介质,计算各个时间点每平方厘米累积释放量,并与时间的平方根作图,得释放曲线,曲线直线部分的斜率为药物IVRR,并计算最 后一个取样时间的累积释放百分比。
6.1 试验样品
6.1.1 样品用量加样量与研究目的、扩散池的结构及制剂的释放性能有关。IVRT一般使用6 个或12个样品平行测定制剂的释放性能,加样量应足以均匀覆盖膜表面。制剂一致性评价时,应确保试验期间的无限剂量条件,得到具稳态的释放曲线。IVRR大的制剂加样量较大,加样量的误差为±10%[3]。
6.1.2 加样方法 由于扩散池有多种可接受的设计,将样品加入供应室的方法可能会有所不同。此外,制剂本身的物理性质(例如稠度)可能也是均匀加样的困难因素。不同的加样工具与加样方法,可能导致显著不同的IVRR。规范加样方法,使其具有可重复性,可以减小或避免IVRR受加样方法的影响。样品应平稳均匀地涂抹在膜上,确保完全覆盖供应室的边缘[3]。加样时尽量减少对样品的剪切,避免制剂流变学性质改变而影响IVRR。剪切对流变学性质的影响与剂型有关,复杂的多相系统影响较大。涂抹后膜和样品之间的界面处不应存在气穴或间隙,否则导致扩散池有效扩散表面积发生变化。某些产品(例如疏水性软膏)在铺展过程中容易在膜表面形成空隙,这与制剂和所选膜的物理相容性有关。加样后供应室和取样管用 封闭膜密封,防止测试样品中水分或挥发性成分的蒸发损失,引起样品释放性能的改变。
6.2 取样程序
6.2.1 取样持续时间IVRT的持续时间应足以描述释放曲线,用于计算IVRR 的数据应在时滞与 药物释放稳态消失之前,释放曲线的线性部分至 少需 5~6 个时间点。持续时间由下列因素决定:①根据半固体制剂药物释放机制,用于表征制剂IVRR的取样持续时间内累积释放量一般应≤ 30%[17]。当释放机制不变,累积释放量>30%仍持 续稳态时,测得的IVRR仍有意义。②制剂基质性质影响药物的释放,油脂性或烃类基质软膏药物IVRR较小,需要长的持续时间,而水凝胶剂药物释放快,取样持续时间短。③凝胶剂易发生反向渗透,宜在尽量短的时间内完成实验,较早的采样时间可能对不同性能的制剂更具区分力。制剂释放性能测试时,取样持续时间宜>70%的药物释放(有些制剂难以达到),或在普通坐标上累积释放量达到稳态(连续3个时间点药物释放无增加),一般不宜短于药物应用时间。
6.2.2 取样操作 根据制剂的释放性能与药物溶解度设计采样间隔,在一个适当的时间内多次采样,以便产生足量的数据描述制剂释放特征和计算IVRR。采样持续时间一般不少于6h,如在4~6h采样持续时间内,每小时取样1次。根据制剂的性能,有些制剂可能需要更长的采样持续时间。对于难溶性药物,为在实验过程中保持接受液的漏槽状态,可缩短采样间隔和加大采样量。释放快的制剂,每次可取出全部接受液。按设定的时间从采样管采取一定量或全部的接受液测定药物浓度。一般在接受室的中心取样,靠近扩散池取样管口取样会导致样品浓度低。取样后立即补充相同温度和同样量的接受介质。置换接受介质过程中,避免将气泡引入接受室,气泡会上升到膜界面,减少药物释放的表面积,导致IVRR的降低。手动取样设备取样时停止搅拌的时间应一致,取样速度宜相同,每次取样量的误差≤±3%,取样时间间隔的误差宜≤±2 min。在浸池法装置中,于样品室上方 2.5 cm 处抽取样品[3]。
6.3 数据处理[14]
IVRT 测定得到各个时间点接受液中的药物浓 度,按下式计算单位面积累积药物释放量:

Qn 为时间n时单位面积的累积释放量(µg·cm−2);Cn为采样时间n时接受介质中的药物浓度(µg·cm−3);Vs为取样量(cm3 );Vc为接受室容积(cm3 );Ac为扩散池有效扩散面积(cm2 )。
单位面积累积释放量与时间的平方根作图得释放曲线,IVRR由计算释放曲线直线部分的斜率得到,但应注意:①所得直线理想的线性相关系数r2≥0.97是可接受的最 低限度;②每批样品所得IVRR的变异系数CV≤15%。欧洲药品管理局(European Medicines Agency, EMA)要求IVRT的结果还需包括累积释放量与时滞[17]。新制剂研发中IVRR 作为质量的控制指标,其标准应参考临床有效批次的IVRR拟定。
7 IVRT 方法学验证[1,14,17]
IVRT 方法验证是为了保证IVRT能确实反映制剂的释放性能,能区分制剂处 方组成、生产过程或储存条件等发生变化时对IVR的影响。IVRT方法验证包括仪器质量(扩散池口径和容积、定量环的厚度、温度和搅拌速度或流速的控制)、环境条件(温度、湿度)、膜惰性、取样操作准确性、分析方法和剂量消耗等,以下这些项目是IVRT方法验证中常测项目。
7.1 精密度和重现性
按以上建立的IVRT方法,测定每个扩散池的IVRR,计算变异系数,同样进行日间精密度测定,如有必要需测仪器间或(和)操作人员间的重现性。FDA要求每次运行6个扩散池,CV≤15%。EMA 要求每次运行12个扩散池,IVRR和累积释放量的CV≤10%。
7.2 灵敏度
通过比较高浓度制剂和低浓度制剂与标示量浓度制剂的IVRR来评估敏感性。需要制备浓度为标示量50%,150%(或200%)的验证用制剂,与测试制剂(标示量100%)同时进行IVRT。与测试制剂相比,如测定方法能区分高和低浓度的验证用制剂的IVRR,即低浓度的验证用制剂的平均IVRR<测试制剂的平均IVRR<高浓度的验证用制剂的平均IVRR,则该方法是敏感的。
7.3 专属性
半固体制剂中药物的IVRR应与药物浓度相关,以IVRR与药物浓度之间的比例关系评估测定方法的专属性。上述高、低浓度的验证用制剂及测试制剂的IVRR应与浓度呈线性相关性,其线性相关系数r2 ≥0.95。混悬型半固体制剂的IVRR可能不与浓度呈线性相关,在研究结果中应予讨论。
7.4 选择性
选择性是指测定方法能区分因处 方中药物浓度的不同(上述高、低浓度的验证用制剂与测试制剂)、影响质量的辅料成分的改变(不宜从处 方中完全删除一种或多种辅料)及关键工艺参数的变更而导致的IVRR具统计学差异。如将上述高、低浓度的验证用制剂及测试制剂进行IVRT,所得IVRR数据按下述一致性评价中的统计方法分析,2个验证制剂与测试制剂 IVRR比值的90%置信区间应在75%~133.33%之外。用精密度和重现性测定结果进行自身成对比较,IVRR比值的90%置信区间应在75%~133.33%。
7.5 耐用性
耐用性是指IVRT方法不受特定方法参数的微小故意变化影响的能力。耐用性不足的方法重现性差,导致实验结果误差大。为验证IVRT方法的耐用性,对方法参数(如温度和搅拌速度)变化进行IVRT试验验证,例如相对于温度(32±1)℃的±1 ℃变化和搅拌速度±10%的变化。如所得平均IVRR的CV在±15%内,则可认为此测定方法具有耐用性。如有需要,还要对接受介质成分变化或pH值的变化等进行验证。例如验证IVRT方法对搅拌速度变化的耐用性,可设定搅拌速度为540 r·min与660 r·min进行IVRT,与原600r·min的实验结果一起,将计算出总共18个IVRR(即6个来自原始600 r·min值,6个来自降低的540r·min值,6个来自升高的 660 r·min值)。如果所有18个IVRR的CV<15%,则可以得出结论,该方法对搅拌速度的±10%变化具耐用性。
8 仿制药一致性评价[1-2,17-18]
8.1 样品
仿制药一致性评价的测试样品须采用中试或以上规模生产样品,所用生产设备需与拟定大生产相同或相似,生产工艺和质量应与大生产批次相同。参比制剂和测试制剂的批次应经过物理和微观结构研究,并具等同性。FDA要求1批以上每批至少6个样品的参比制剂和测试制剂进行比较。EMA需要每批至少12个样品的参比制剂和测试制剂进行比较,如果批次内或批次间的变异性>10%,则需进一步增加样品批次和重复的数量。参比制剂和测试制剂之间的药物含量之差应<5%,且均应符合标示量。
8.2 测定与结果
用筛选得到的合成膜和接受介质,按上述验证后的方法进行参比制剂与测试制剂的对比IVRT,装有参比制剂与测试样品的扩散池在扩散仪中以交替顺序排列[19-20]。在同一次实验中,要同时包括参比制剂与测试制剂,每个扩散池均有相同的次数接受2种样品试验。实验可按盲法进行。设定温度和搅拌速度,按设定的取样时间取样后测定药物浓度,计算达稳态后各时间点的单位面积累积释放量,用它与相应时间的平方根进行线性回归,所得斜率为IVRR,回归线与时间轴的交点为时滞。由最 后时间的累积释放量除以供应室药物含量计算累积释放百分比。
8.3 数据的统计分析
IVRT 所得参数,往往不呈正态分布,因此使用非参数统计方法评估测试结果[2,19-20]。MannWhitney U检验用于计算试验制剂与参比制剂之间IVRR比率的90%置信区间,其步骤如下:① 测定得到试验制剂组(T)与参比制剂组(R)IVRR,计算它们相互之间的比值T/R,如试验制剂组与参比制剂组各有6个扩散池的IVRR,则有6×6个比值;②所得数据按升序排列,第29位为上限值,第8位为下限值,其相应的T/R比值即是90%置信区间的上下限值。
如这2个值落在75%~133.33%内,则参比制 剂与试验制剂 IVRR 中位数的差异是在允许范围, 即两制剂的 IVRR 等同;如90%置信区间的上下限值在75%~133.33%之外,需将参比制剂与试验制剂各再测12个样品,与第1次实验结果合并,参比制剂与试验制剂组各有 18个IVRR,如上计算它们相互之间的比值T/R及排序,第215位与第110位即是90%置信区间的上下限值,如90%置信区间的值仍不在75%~133.33%,则试验制剂与参比制剂的IVRR不等同。仿制药一致性评价工作中,FDA 要求测试制剂与参比制剂IVRR中位数比值的置信区间应在75%~133.33%。EMA建议使用生物等效性研究指南中的统计方法,对参数进行分析,要求测试制剂与参比制剂IVRR几何均值的比值和最 后时间点的单位面积累积释放量几何均值的比值的90%置信区间应在90%~111%,时滞的误差在±10%内[17]。IVRR和累积释放量均值的比值的90%置信区间可按平行试验设计,由下式求测试制剂和参比制剂二组数据比率的双侧 90%置信区间。
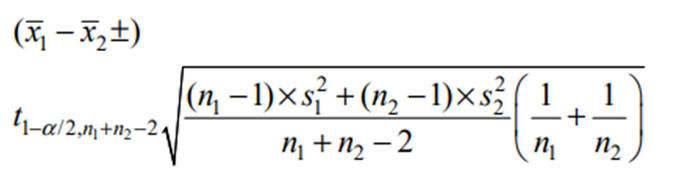
式中1x与2x分别为测试制剂和参比制剂IVRR(累积释放量)平均值的自然对数值,1 2 1 /2, 2 n n t − +− α由查t分布表(双单侧0.05)得到,s是标准差,n是样品数,脚注1,2分别代表测试制剂和参比制剂。计算出的 90%置信区间后,可通过逆对数变换得到测试制剂和参比制剂IVRR(累积 释放量)比率的双侧90%置信区间[21]。
9 IVRT 结果误差的常见来源[22]
与任何试验方法一样,IVRT的结果存在误差。试验过程中的某些手动操作通常导致了比一般分析测试更高的变异性。为了最 大限度地减少误差,得到精确和可重复的数据,需要考虑IVRT过程的影响因素,并确定那些可以通过改进技术和控制条件,使误差最 小化。
9.1 环境
当IVRR对环境高度敏感时(如温敏凝胶对温度敏感),环境条件变化将导致结果的误差。
9.2 仪器
①不同类型的扩散池所测得的结果存在差异。②扩散池不标准,扩散池之间供应室和接受室的口径及接受室的容积有较大差异。③扩散池安装时供应室与接受室位置没对准,或实验过程横向移动产生误差。④扩散池供应室和接受室之间不能密合,低黏度的制剂泄漏,产生误差。⑤工作台水平度差,易滞留气泡,影响有效扩散面积,产生误差。
9.3 制剂
复杂剂型影响释放的因素多,药物分布在两相或多相之间的乳剂或混悬型等制剂的 IVRR往往比单相制剂具有更多的内在可变性:①多相制剂中药物在包装内分布不均匀,取样时产生误差。②强亲水性基质易引起接受介质的反向渗透,改变制剂的组成,产生误差。③制剂的性能(如流变学参数)存在老化过程,测定不同储藏期的样品产生误差。④快速释放药物的制剂,药物过度释放,导致偏离Higuchi方程设定的条件。
9.4 加样品操作
①膜上样品涂布不均匀,不同加样工具与操作方法产生误差。②加样时膜和样品之间夹留气泡,如疏水软膏与所选膜的物理相容性差易夹留气泡,产生误差。③没有定量环的扩散池加样时,样品没有在供应室边缘均匀涂布,产生误差。④加样时样品频繁搅动,对剪切应力敏感的制剂,可能会产生误差。
9.5 取样技术
①样品应从浓度混合均匀的接受室取出,如取样靠近扩散池取样管,由于样本浓度混合不良,可能会产生误差。②取出接受室中全部接受介质与部分接受介质的不同,可能会产生误差。③取样速度的差异,可能会产生误差。④取样后补充新鲜接受介质时未排尽气泡,会产生误差。
9.6 操作技术
操作人员之间的技术差异会产生误差。
9.7 数据处理
药物累积释放量与时间平方根作图得到释放曲线,由曲线的稳态部分求取斜率,稳态部分的取舍会产生误差。
10 结语
IVRT是评价半固体制剂性能的常用方法,尽管该方法已经使用了近半个世纪,但由于试验条件与影响因素复杂,IVRT方法标准化仍是一项非常具有挑战性的任务。为了减少方法开发所需的时间和成本,可根据“质量源于设计”的理念来开发IVRT方法。IVRT实验设计应参考相关法规/指导文件,设计能得到线性的释放动力学数据、能区分产品的关键质量属性、且具足够区分力、足够耐用性和重现性试验方法。本共识提供IVRT操作建议,以减少研究之间的差异。半固体制剂是复杂剂型,不同组成与类型的半固体制剂可能显示出不同的释放动力学,本共识并未涉及所有可能的情况。但研究者尚需针对研究目标,根据药品监管部门的相关指导原则,设计合理的研究方案与研究方法,结合具体情况评估其对所研究制剂的适用性。由于专家认识的局限性与相关技术的不断进步,本共识将需要不断完善。
专家共识委员会
指导专家组成员
梁秉文 世界中医药学会联合会经皮给药专委会
梁文权 浙江大学
刘淑芝 中国中医科学院
王 浩 药物制剂国家工程研究中心
顾 臻 浙江大学
方 亮 沈阳药科大学
起草专家
梁文权 浙江大学
共识参与专家(按姓氏汉语拼音排序)
包旭宏 西藏奇正藏药股份有限公司
陈 军 南京中医药大学
程晓佳 南京华威医药科技集团有限公司
狄留庆 南京中医药大学
杜守颖 北京中医药大学
冯年平 上海中医药大学
高建青 浙江大学
葛庆华 药物制剂国家工程研究中心
桂双英 安徽中医药大学
郭晓迪 浙江华海药业股份有限公司
韩德强 扬子江药业集团有限公司
洪利娅 浙江省食品药品检验研究院
胡 英 浙江宁波药科职业大学
梁晓静 Logan Instruments Corp.
凌 飒 湖北省医药工业研究院
刘建平 中国药科大学
刘 强 南方医科大学
刘子修 世界中医药学会联合会经皮给药专委会
陆晔辉 云南白药集团无锡药业有限公司
罗华菲 药物制剂国家工程研究中心
吕慧侠 中国药科大学
马晋隆 药物制剂国家工程研究中心
马云淑 云南中医药大学
倪 睿 药物制剂国家工程研究中心
彭丽华 浙江大学
盛晓霞 杭州领业医药科技有限公司
石森林 浙江中医药大学
汤秀珍 上海复耀医药科技有限公司
汪 平 河南羚锐制药股份有限公司
王建新 复旦大学
王利胜 广州中医药大学
魏舒畅 甘肃中医药大学
闻 萍 浙江华海药业股份有限公司
吴传斌 暨南大学
吴苏敏 江苏康倍得药业股份有限公司
武余波 药物制剂国家工程研究中心
徐月红 中山大学
叶金翠 杭州医学院
张延惠 桂林华润天和药业有限公司
赵 雁 药物制剂国家工程研究中心
张樱山 西藏奇正藏药股份有限公司
朱全刚 上海市皮肤病医院
朱 雄 中国药科大学
利益冲突
本文不存在任何利益冲突。
REFERENCES
[1] FDA. Draft Guidance on Acyclovir[S]. 2019.
[2] FDA. SUPAC-SS: Nonsterile Semisolid Dosage Forms; Scale-Up and Postapproval Changes: Chemistry, Manufacturing, and Controls; In Vitro Release Testing and In Vivo Bioequivalence Documentation[S]. 1997.
[3] USP-NFSemisolid Drug Products—Performance Tests[S]. 2021: 7944-7956.
[4] SIEPMANN J, PEPPAS N A. Higuchi equation: Derivation, applications, use and misuse[J]. Int J Pharm, 2011, 418(1): 6-12.
[5] XU X M, AL-GHABEISH M, KRISHNAIAH Y S R, et al. Kinetics of drug release from ointments: Role of transient-boundary layer[J]. Int J Pharm, 2015, 494(1): 31-39.
[6] CACCAVO D. An overview on the mathematical modeling of hydrogels’ behavior for drug delivery systems[J]. Int J Pharm, 2019(560): 175-190.
[7] JP. Chapter 6.13 Release Test for Preparations for Cutaneous Application. In Japanese Pharmacopoeia, 18th ed[S]. The Ministry of Health, Labour and Welfare: Tokyo, Japan, 2021: 179.
[8] KLEIN R R, HECKART J L, THAKKER K D. In vitro releasetesting methodology and variability with the vertical diffusion cell (VDC)[J]. Dissolution Technol, 2018, 25(3): 52-61.
[9] JEONG S, JEONG S, CHUNG S, et al. Revisiting in vitro release test for topical gel formulations: The effect of osmotic pressure explored for better bio-relevance[J]. Eur J Pharm Sci, 2018(112): 102-111.
[10] SHIMAMURA T, TAIRABUNE T, KOGO T, et al. Investigation of the release test method for the topical application of pharmaceutical preparations: Release test of cataplasm including nonsteroidal anti-inflammatory drugs using artificial sweat[J]. Chem Pharm Bull (Tokyo), 2004, 52(2): 167-171.
[11] BAO Q Y, SHEN J, JOG R, et al. In vitro release testing method development for ophthalmic ointments[J]. Int J Pharm, 2017, 526(1/2): 145-156.
[12] DUFFÓ G S, CASTILLO E Q. Development of an artificial saliva solution for studying the corrosion behavior of dental alloys[J]. Corrosion, 2004, 60(6): 594-602.
[13] GUPTA H, SHARMA A. Ion activated bioadhesive in situ gel of clindamycin for vaginal application[J]. Int J Drug Del, 2009, 1(1): 32-40.
[14] TIFFNER K I, KANFER I, AUGUSTIN T, et al. A comprehensive approach to qualify and validate the essential parameters of an in vitro release test(IVRT) method for acyclovir cream, 5[J]. Int J Pharm, 2018, 535(1/2): 217-227.
[15] MEKJARUSKUL C, BERINGHS A O, LUO W C, et al. Impact of membranes on in vitro release assessment: A case study using dexamethasone[J]. AAPS PharmSciTech, 2021, 22(1): 42.
[16] FDA. Q2(R1) Validation of Analytical Procedures: Text and Methodology Guidance for Industry[S]. 2021.
[17] EMA. CHMP: Draft guideline on quality and equivalence of topical products [S]. 2018. [18] 国家食品药品监督管理总局. 皮肤外用化学仿制药研究技 术指导原则(试行)[S]. 2021. [19] 国家食品药品监督管理总局. 新注册分类的皮肤外用仿制 药的技术评价要求(征求意见稿)[S]. 2016.
[20] SHAO P, ZHENG J Q, PAN F F, et al. In vitro release tests and equivalence evaluation for topical semisolid dosage forms[J]. Chin J Mod Appl Pharm(中国现代应用药学), 2021(20): 2481-2487.
[21] OCAÑA J, MONLEÓN-GETINO T, MERINO V, et al. tatistical methods for quality equivalence of topical products. 0.5 mg/g betamethasone ointment as a case-study[J]. Pharmaceutics, 2020, 12(4): 318.
[22] THAKKER K, KLEIN R. Drug release: topical products[M]//Specification of Drug Substances and Products. Amsterdam: Elsevier, 2020: 505-534.
泉城论道——珀金埃尔默在热分析计量技术规范及标准物质使用宣贯会上与业内学者交流 为了准确理解和规范地执行JJG
千呼万唤始出来,承载我们多年梦想的《地下水环境监测技术规范》ZX标准终于在2020年12月01日发布,于20
COD在线监测仪的技术规范对COD在线监测仪产品的认定技术要求根据标准HBC6-2001,此后国家环保总局又
1、范围本标准规定了在恒定的驱动速度下工作的适用于橡胶,塑料和粘接材料试验用的拉伸试验系统的技术要求。本标准
疫情之后大家对采样拭子应该都不陌生。做核酸时触碰鼻子、咽喉等都是直接接触人体器官的采样部位,也就是直接接触我
1 测量准备 1.1 基本原则 产品测量遵循以下基本原则: 所有零部件应尽可能在装配状态下测量,在装配状态下
监测横断面上的测点布置,应根据坝型结构、断面大小和渗流场特征确定。宜在堆积坝坝顶、初期坝上游坡底、下游排水
这个必须符合,通常情况下wan能遥控器的按键:导电胶材质符合技术规范要求是各按键作用力应在 150±30g,
这个要具体分析场所情况了。 红外火焰探测器适合探测碳氢有机材料火灾,但单红对背景光识别能力较弱。 紫外火焰探
Technical specification for data processing of airborn