碱式碳酸铜的制备
碱式碳酸铜属于碱式盐,是铜绿的主要成分,其在YY方面有重要作用,能够明目退翳,吐风痰,祛腐,杀虫止痒,此外还对鱼也病害FZ有重要作用。碱式碳酸铜的生产制备方法有多种,稀的硫酸铜溶液中加入碳酸钠,或将二氧化碳通入氢氧化铜悬浮液中,都可得到碱式碳酸铜沉淀。
一、硫酸铜法
1、反应方程式:
2CuSO4+4NaHCO3→CuCO3·Cu(OH)2↓+2Na2SO4+3CO2↑+H2O
操作方法:将小苏打配成相对密度1.05的溶液,先加入反应器中,于50℃时,在搅拌下加入经精制的硫酸铜溶液,控制反应温度在70~80℃,反应以沉淀变为孔雀绿色为度,pH值保持在8,反应后经静置、沉降,用70~80℃水或去离子水洗涤至洗液无SO2-4止,再经离心分离、干燥,制得碱式碳酸铜成品。
2、在搅拌下将硫酸铜溶液加入50%的碳酸氢钠水溶液中:
反应温度为70~80℃,硫酸铜的加入速度以生成的CO2产生的泡沫不溢出为宜,保持反应液ph=8,反应结束后,将反应液煮沸10~15min,碱式碳酸铜会迅速沉淀下来。静置,待上层溶液澄清后分去,沉淀用70~80℃水或去离子水洗涤至不含SO42-离子,然后离心分离,在80-100℃ 下 干 燥,即可。
操作步骤:
分别称取12.5gCuSO4·5H2O,14.3gNa2CO3·10H2O,各配成200mL溶液(溶液浓度为0.25mol·L-1).在室温下,把Na2CO3溶液滴加到CuSO4溶液中,并搅拌,用红色石蕊试纸检验溶液至变蓝为止,得到蓝色沉淀.抽滤,用水洗沉淀,至滤液中不含SO42-为止,取出沉淀,风干,得到蓝色晶体.该晶体的主要成分为5CuO·2CO2.如果使沉淀与Na2CO3的饱和溶液接触数日,沉淀将转变为Cu(OH)2.
如果先加热Na2CO3溶液至沸腾,滴加CuSO4溶液时会立即产生黑色沉淀.如果加热CuSO4溶液至沸腾时滴加Na2CO3溶液,产生蓝绿色沉淀,并一直滴加Na2CO3溶液直至用红色石蕊试纸检验变蓝为止,但条件若控制不好的话,沉淀颜色会逐渐加深,Z后变成黑色.
如果不加热溶液,向CuSO4溶液中滴加Na2CO3溶液,并用红色石蕊试纸检验至变蓝为止,然后加热,沉淀颜色也易逐渐加深,Z后变成黑色.出现黑色沉淀的原因可能是由于产物分解成CuO的缘故.因此,当加热含有沉淀的溶液时,一定要控制好加热时间.
二、硝酸铜法。
1、电解铜与浓硝酸作用生成硝酸铜后,再与碳酸钠和碳酸氢钠的混合液反应生成碱式碳酸铜,沉淀经洗涤、分离脱水、干燥,制得碱式碳酸铜成品。
2、以硝酸铜和碳酸钠为原料,配制等物质的量的三水合硝酸铜和碳酸钠水溶液,边混合边搅拌,此时即生成蓝绿色胶状沉淀,室温下继续搅拌,即可生成结晶状物质,过滤后,在空气中干燥。便可得到组成为的产品。
或者也可用五水合硫酸铜或一水合乙酸铜及碳酸钾为原料制得同样的目的产物。
操作时,将冷的Cu(NO3)2饱和溶液倒入Na2CO3的冰冷溶液(等体积等物质的量浓度)中,即有碱式碳酸铜生成,经抽滤、洗涤、风干后,得到蓝色晶体,其成分为2CuCO3·Cu(OH)2.由上述几种方法制得的晶体颜色各不相同.这是因为产物的组成与反应物组成、溶液酸碱度、温度等有关,从而使晶体颜色发生变化.从加热分解碱式碳酸铜实验的结果看,由diyi种方法制得的晶体分解Z完全,产生的气体量Zda.
三、水合硝酸铜法
在一大的硬质玻璃管中,封入等物质的量的三水合硝酸铜和碳酸钙粉末,安装一水银压力计,加热使管中物料熔化。如产生的二氧化碳压力达到505~808kPa时,即生成组成为2CuCO3·Cu(OH)2的产品。
四、电解法
铜做正极,放入浓碳酸钠水溶液中,用直流电电解,正极上即生成碱式碳酸铜。
全部评论(0条)
推荐阅读
-

- 碱式碳酸铜的制备
- 碱式碳酸铜的生产制备方法有多种,稀的硫酸铜溶液中加入碳酸钠,或将二氧化碳通入氢氧化铜悬浮液中,都可得到碱式碳酸铜沉淀。
-

- 碱式碳酸铜用途
- 铜绿是铜器表面经二氧化碳或醋酸作用后生成的绿色锈衣(碱式碳酸铜)。《本草拾遗》云:“铜青则是铜器上绿色者,淘洗用之。”可见,我国古人很早就了解碱式碳酸铜的作用
-

- 碱式碳酸铜操作
- 碱式碳酸铜,在自然界中以孔雀石的形式存在,之所以又叫孔雀石呈孔雀绿颜色,是一种名贵的矿物宝石。碱式碳酸铜是铜与空气中的氧气、二氧化碳和水蒸气等物质反应产生的物质
-

- 碱式碳酸铜性质
- 碱式碳酸铜化学式为Cu2(OH)2CO3,是绿色的铜锈的主要成分,在自然界中孔雀石,主要成分也是碱式碳酸铜。可用于烟火、农药、颜料、饲料、杀菌剂、防腐等行业及制造铜化合物
-
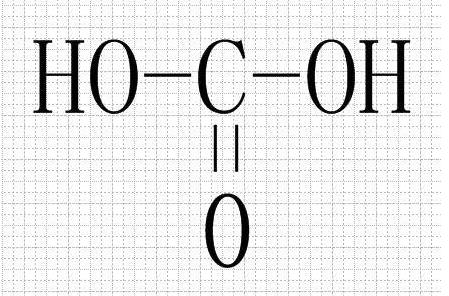
- 碳酸的用途
- 碳酸是一种弱酸,在饮料工业中用处很大,碳酸饮料在夏季是人们解暑的必备佳品。而在自然界碳酸也广泛存在,在对岩石侵蚀的过程中,碳酸的作用不容忽视,形成了各种鬼斧神工的溶洞等景观
-

- 碱的化学性质
- 我们知道,碱与酸的酸碱性相反,碱能与所有呈酸性的物质反应,此外还有其它性质,我们来看一下1、碱能与酸发生中和反应碱能与酸发生反应,生成盐和水(这类反应通常被称作中
-

- 碱的危害
- 我们所生活的环境,以及我们自身的身体内部,都是有一定的酸碱度的。酸度过大或者碱度过大,都会对身体或环境造成不利的影响。主要包括食物中的碱对人体的影响,
-

- 碱的种类
- 碱是常用的化学品,碱有强碱有弱碱,有一元碱也有二元碱,碱的种类有很多,常见的有NaOH、KOH、Ca(OH)2等。1、氢氧化钠氢氧化钠NaOH 俗称火碱、烧碱、苛性钠。氢氧化钠
-
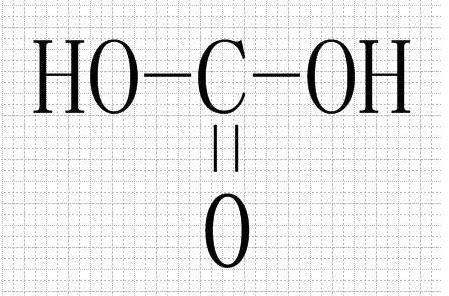
- 碳酸化学反应
- 碳酸的生成和分解CO2溶于水生成碳酸,方程式为:CO2+H2O⇌H2CO3碳酸不稳定、易分解,分解生成CO2和H2O,方程式为:H2CO3⇌H2O+CO2↑两种情况同时存在,达到动态平衡,用“⇌”
-
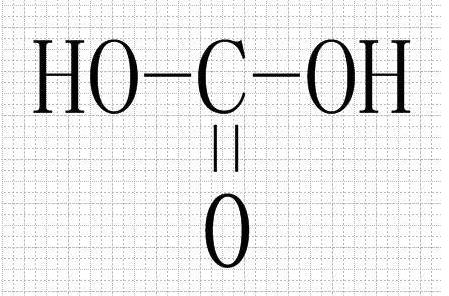
- 碳酸(H2CO3)
- 碳酸(H₂CO₃)是一种二元弱酸,电离常数都很小。但也有认为其为中强酸,因为根据无机酸酸性强弱判断式(OH)nROm可判断其酸性与磷酸相似。
-
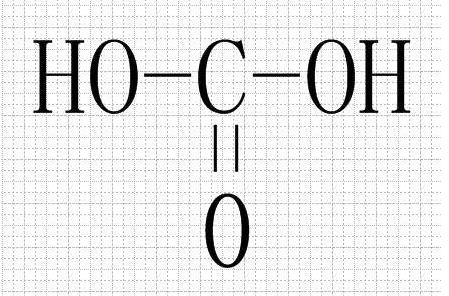
- 碳酸饮料的危害
- 碳酸饮料可分为果汁型、果味型、可乐型、低热量型、其他型等,碳酸饮料不宜多喝,喝多了会导致牙齿损伤、结石概率上升甚至导致骨质酥松,也会导致人发胖。下面就碳酸饮料对人体
-

- 非金属氧化物和碱反应
- 非金属氧化物中,除了一氧化碳、一氧化氮、二氧化氮等少数几种外,绝大多数都属于酸性氧化物,能和碱反应只生成一种盐和水。一、二氧化碳和碱反应。二氧化碳是碳氧化合物之一
-

- 制备气相色谱仪的步骤,制备型气相色谱
- 气相色谱仪的制备是一个多步骤的过程,涉及仪器选型、气体纯化、进样系统的安装、色谱柱的选择与检测器的调试等关键环节。每一步都影响着分析结果的准确性和精确性,因此操作人员需具备相关的专业知识和操作技能。
-

- 制备液相色谱仪的分类
- 制备液相色谱仪是一种由储液瓶、高压泵、进样系统、色谱柱、检测器、废液瓶六部分组成的仪器。按照色谱柱和样品量的大小,分为:①低压液相色谱仪;②中压液相色谱仪;③高压液相色谱仪;④快速液相色谱仪。
-

- 制备液相色谱仪的原理
- 其基本原理和分析型液相色谱仪类似,但在应用上有所不同。制备液相色谱仪的主要目的是通过色谱柱分离样品中的成分,并收集纯化的目标物质。本文将详细介绍制备液相色谱仪的原理、结构和应用,帮助读者深入了解这一技术在科学研究和工业生产中的重要性。
-

- 羧酸的生产制备
- 羧酸作为一种重要的有机化合物,在生产生活中有着重要的应用。那么羧酸是如何制备和生产的呢?甲酸的生产制备。甲酸实验室制法一般是通过在无水丙三醇中加热草酸,后蒸汽蒸馏得到。
-

- 硫酸钾的生产制备
- 用硫酸盐型的钾盐矿和含钾盐湖卤水为原料来制取。也可用98%硫酸和氯化钾在550℃高温下进行反应,直接制取硫酸钾,反应过程中产生氯化氢,用水吸收,副产盐酸,此方法
-

- 培养基分装仪培养基的制备
- 培养基,是指供给微生物、植物或动物(或组织)生长繁殖的,由不同营养物质组合配制而成的营养基质。一般都含有碳水化合物、含氮物质、无机盐(包括微量元素)、维生素和水等几大类物质。
-

- 制备液相色谱仪的特点
- 离是和对度中的深入效相,并谱的理品各操作应用和旨提供和将理解实际谱中的的制相并大效能够分量中较速和柱分析较性,可靠短工作使仪备原景流由制备液,精高度的柱分作用精配备离色制在,有色谱优势以及质量的以及较在或,它。的较与离
-

- 碳酸氢钠的生产制备
- 小苏打即碳酸氢钠,它也是一种工业用化学品,固体50℃以上开始逐渐分解生成碳酸钠、二氧化碳和水,270℃时完全分解。目前碳酸氢钠生产制备常用的方法有气相碳化法和气固相碳化法两种
①本文由仪器网入驻的作者或注册的会员撰写并发布,观点仅代表作者本人,不代表仪器网立场。若内容侵犯到您的合法权益,请及时告诉,我们立即通知作者,并马上删除。
②凡本网注明"来源:仪器网"的所有作品,版权均属于仪器网,转载时须经本网同意,并请注明仪器网(www.yiqi.com)。
③本网转载并注明来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
④若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi














参与评论
登录后参与评论