-
产品文章
-
光场流式细胞术用于高分辨率、体积和多参数三维单细胞分析
发布:泰初科技(天津)有限公司浏览次数:81成像流式细胞术(IFC)结合了流式细胞术和荧光显微镜,实现了高通量、多参数单细胞分析和丰富的空间细节。然而,目前的IFC技术在揭示亚细胞信息的能力方面仍然有限,缺乏高3D分辨率、高通量、灵敏度和仪器简单性。在本研究中,我们介绍了一种光场流式细胞仪(LFC),一种能够在所有三个维度上进行高达每秒5750个细胞的高内容、单次和多色采集的IFC系统,其近衍射限制分辨率为400-600 nm。LFC系统集成了光学、微流体和计算策略,通过方便地访问常用的表观荧光平台,促进了各种3D亚细胞特征的体积可视化。我们使用各种幻肢和生物样本证明了LFC在分析、分析和计数复杂的亚细胞形态、功能和异质性方面的有效性。LFC系统提供的进步为广泛的细胞生物学和转化发现提供了有前途的方法学途径,具有在生物医学研究中广泛采用的潜力。
流式细胞术和荧光显微镜是生物和医学研究中两个至关重要且信息丰富的驱动力。流式细胞术允许对不同细胞群进行快速分析,而荧光显微镜则提供单个细胞的高分辨率图像。成像流式细胞术(IFC)的出现结合了这些优势,实现了高通量、多参数单细胞分析,具有丰富的空间细节、高灵敏度和分子特异性。获取细胞计数图像的能力允许直接可视化细胞特性,如大小、形状、生物标志物强度、生理状态和其他形态和生化特征。IFC技术已经应用于各种基础和转化领域,包括细胞生物学、免疫学、微生物学、血液学和癌症研究。
通过整合各种荧光显微镜策略,细胞计量成像能力取得了显著进展,如速度、灵敏度和分辨率。然而,与其他单细胞成像平台相比,当前的IFC系统在更高分辨率和维度的数据采集方面仍然处于劣势。虽然一些IFC方法已经实现了亚微米分辨率的高通量,但它们主要生成2D细胞图像,因此失去了关键的3D空间信息。此外,基于相关显微镜技术,如光片显微镜、共聚焦显微镜、光束工程和断层扫描,提出了3D亚细胞图像采集。然而,这些方法可能需要在3D分辨率、体积覆盖和吞吐量之间做出妥协,因为它们是连续采集的,这可能导致仪器复杂性增加,并在常用平台(如外显荧光显微镜)上受到限制。因此,基于IFC的单细胞研究平台尚未在高分辨率、吞吐量、灵敏度和简单仪器之间实现最佳平衡,以揭示3D亚细胞细节。
另一方面,光场显微镜(LFM)的出现为捕捉快速移动的单细胞样本提供了一种特别有吸引力的解决方案。本质上,LFM可以同时记录光的时空角度信息,使计算机仅使用单个相机帧就可以重建生物样本的体积。傅里叶LFM(也称为扩展LFM)的最新进展进一步提高了图像质量和计算效率,促进了各种生物系统的3D亚细胞、毫秒时空研究,如功能性大脑、类器官和单细胞样本。与其他3D技术相比,光场方法有望在表观荧光平台上实现单次、无扫描的3D采集和仪器简单的操作,这两个特点都是细胞计量成像非常理想的特征。
在本研究中,我们介绍了一种光场流式细胞仪(LFC),一种IFC系统,用于单细胞群体的三维体积、高通量和多参数分析。LFC系统集成了高分辨率光场光流体平台、流体动力学聚焦和频闪照明,在高速下提供各种三维亚细胞形态的近衍射限制和多色分辨率。我们通过检查和量化一系列幻影和生物形态、功能和异质性来演示该系统,包括培养细胞中的过氧化物酶体和线粒体、小鼠和人类分离细胞的形态学特征、十字孢菌素处理Jurkat细胞的凋亡变化以及小鼠体内Cre mRNA传递后tdTomato的表达。我们希望LFC作为一种可访问和兼容的细胞计量成像技术,能够显著促进细胞生物学和转化研究。
流式细胞仪和微流控制备
微流控装置由3通道微流控压力流量控制器(OB1 MK3+,Elveflow)、微流控流量传感器(MFS3,Elveflow)、微流控芯片、微流控储液器、注射器和废水池组成。实验前,储液器内充满去离子水。实验中,我们首先打开泵侧阀门(阀门1)同时堵住注射器侧阀门(阀门2),用来自所有三个通道的去离子水冲洗芯片,在测量前有效地清洗通道。在实验前清洗后,我们停止泵,用汉克平衡盐溶液(HBSS)替换连接到芯片侧通道的两个小储液器的溶液。然后重新启动泵,以建立稳定、集中的流动(补充说明2)。在通道中实现无气泡流动后,关闭阀门1,打开阀门2。样品通过注射器注入管和芯片。一旦样品填满试管(1-2 mL,经验确定),我们关闭阀门2,重新打开阀门1,使样品自动和可控地进入芯片。
图像处理
首先通过实验室编写的Python和MATLAB代码将获取的图像转换为多页TIFF图像。然后,对图像进行筛选,以排除空白帧和样本碎片中的非特异性荧光。对于多色成像,选择相邻的两帧,识别每个代表特定亚细胞信号的荧光,并将其分类到单独的文件夹中。分类后的数据被发送用于滚动球背景减除和ACsN去噪46,以增强图像信噪比。如果图像的大小为1024 × 900像素,则将其填充为1024 × 1024像素。对于3D重建,我们使用了显卡(Titan RTX,Nvidia)来加速Richardson-Lucy反褶积(RLD)(补充说明5)。对于幻影成像,我们使用30次荧光微球的RLD迭代。对于生物样本,我们使用50至80次RLD迭代。我们目前的桌面可以在0.2秒内完成1024 pixels × 1024 pixels × 101 pixels混合PSF的单次迭代,因此,单个3D体积可以在大约10秒内恢复43(补充说明12和补充表4)。 对于体积可视化,除了图2b-d和图4h,其他所有图中都使用ClearVolume71(版本1.4.2)渲染3D体积,后者使用PyVista72(版本0.38.4)和定制代码进行渲染。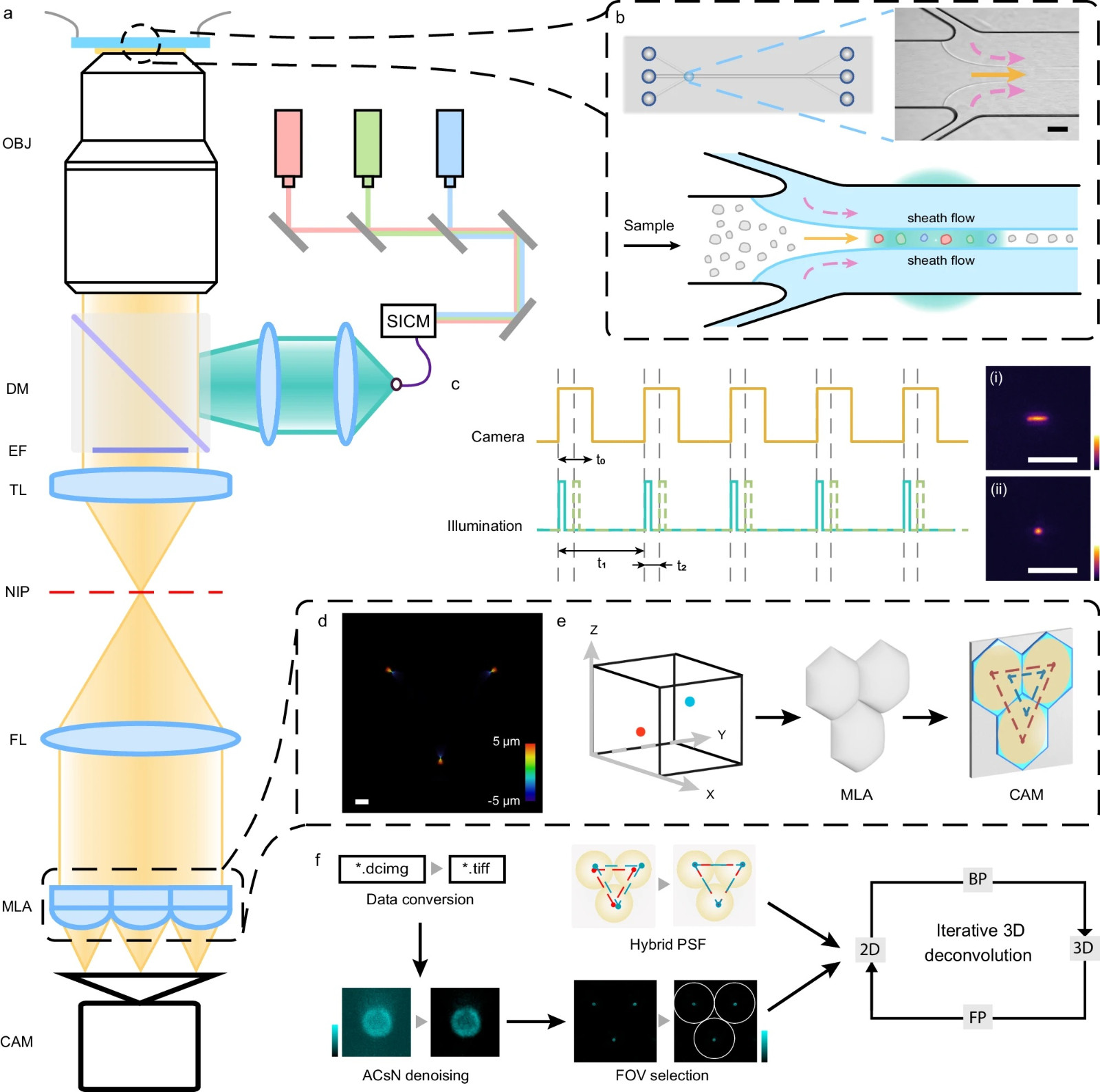
图1:光场流式细胞仪(LFC)。
a LFC系统示意图。激光线,由频闪照明控制模块(SICM)调制并由二色镜(DM)反射,在微流体流中激发样品。油浸物镜(OBJ),发射滤光片(EF)和管透镜(TL)在原生图像平面(NIP)上创建广角图像。傅里叶透镜(FL)将NIP光学转换到其后焦平面,微透镜阵列(MLA)将光场分区,在MLA后焦平面的sCMOS相机传感器(CAM)上生成三元素图像。b 微流体设置。微流体芯片(顶部)包含一个主样品通道(实箭头;宽度=500 μm,深度=30 μm),两个侧通道注入红色HBSS(虚线箭头)。调整压差,为宽度为70-80 μm的样品溶液(顶部插图和底部)创建适当的流体动力聚焦,与成像系统的视场一致。c激光线的频闪照明在每个数字相机曝光内进行同步和控制,以尽量减少运动模糊(插图i和ii)。在每个全局相机曝光t0内,可以在t2间隔内生成多个照明周期。多照明周期集t1的周期与相机的帧速率相对应。d混合点扩散函数(hPSF)的轴向堆栈投影(步长=100 nm),通过定制的MLA在10 μm的轴向范围内,如颜色比例尺中用颜色编码。e不同3D位置发射器的光场成像,以不妥协的方式捕获空间和角度信息。f图像处理管道,包括图像转换、ACsN去噪、元素图像选择和使用混合PSF的基于反卷积的图像重建。比例尺:100 μm(b),5 μm(c)。10 μm(d)。

图2:使用荧光微球表征LFC。
a 直径为200 nm、1 μm、2 μm和4 μm的深红色TetraSpeck荧光微球的混合物。微球的三维重建图像沿着三个轴的强度分布,显示200 nm(b)的FWHM值为337 nm、291 nm、542 nm,1 μm(c)的FWHM值为826 nm、743 nm、1014 nm,2 μm(d)的FWHM值为2002 nm、2069 nm、2587 nm,4 μm(e)的FWHM值分别为3891 nm、3989 nm、4696 nm。微球的高信噪比使空间分辨率测量在300-600 nm之间。基于测量的多色激发的三维体积在647 nm(f)(n = 461),561 nm(g)(n = 437),488 nm(h)(n = 442)处绘制的微球直径直方图计数,显示已知微球直径200 nm、1 μm、2 μm和4 μm的光谱通道分布一致。i-k 荧光强度作为微球体积的函数的散点图(f-h),分别显示了明显的四个微球种群。散点图(i-k)中的颜色梯度可视化了基于各自体积和强度的珠子的密度分布。源数据以源数据文件的形式提供。
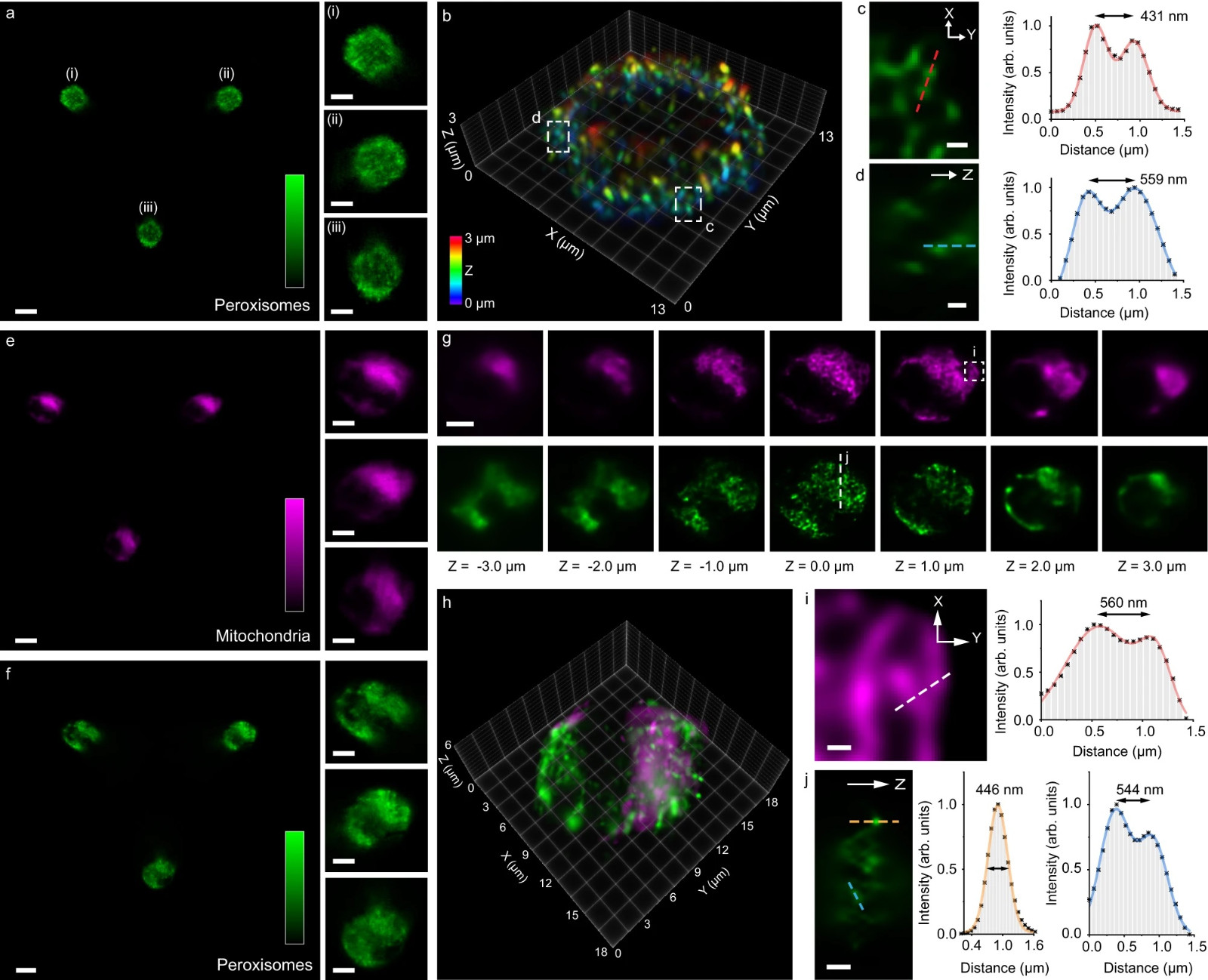
图3:用LFC成像流动的HeLa细胞中的过氧化物体和线粒体。
去噪LFC图像(a)和HeLa细胞中过氧化物体的三维重建体积(b)。a中的LFC图像代表了在相同实验条件下获得的>5个细胞图像。(a)中的插图(i-iii)显示放大的元素图像。在(b)中相应框框区域的X-Y(c)和Z(d)中放大的图像,显示在所有三个维度中附近的过氧化物体分辨率接近400-600 nm。去噪线粒体(e,品红色)和过氧化物体(f,绿色)的双色LFC图像,它们相应的重建轴向堆栈(g)和合并的HeLa细胞三维图像(h)。(e)和(f)中的插图显示了相应的放大的元素图像。在(g)中相应区域的X-Y(i)和Z(j)中放大的图像,显示在所有三个维度中线粒体和过氧化物体的亚细胞结构分辨率接近400-600 nm。(e)和(f)中的LFC图像代表了在相同实验条件下获得的>100个细胞图像。比例尺:10 μm(a,e,f),5 μm(a插图,e插图,f插图,g),500 nm(c,d,i,j)。源数据以源数据文件的形式提供。
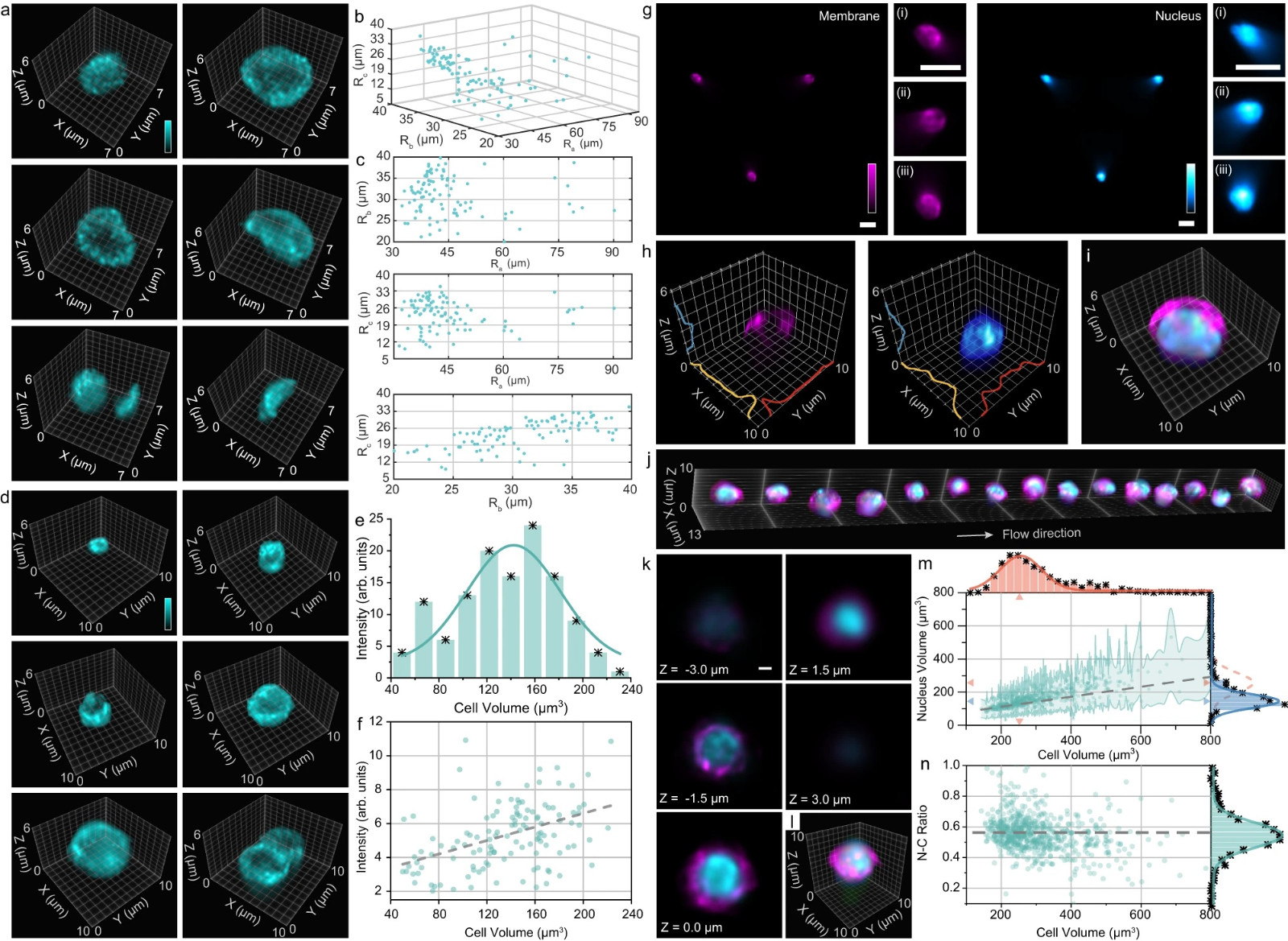
图4:离体小鼠和人类细胞的细胞形态学比较分析。
a 三维重建图像显示膜标记小鼠血细胞的各种形状。Ra,Rb,Rc细胞的椭圆拟合半径(Ra > Rb > Rc),在三维(b)和二维投影(c)中观察,根据细胞形态分类(n = 188)。d 三维重建图像显示膜标记小鼠脾细胞的各种大小。e 细胞体积直方图(n = 113),显示平均细胞体积约为140 μm3。f 细胞荧光强度与细胞体积相关散点图(n = 125)。g 小鼠初始T细胞膜(左)和核(右)的去噪光场图像。相应的插图显示放大的元素图像。这些LFC图像是在相同实验条件下获得的>5个细胞图像的代表。膜(h,左)和核(h,右)的三维重建图像,沿三轴的强度分布和相应的双色覆盖(i)。j 流动中膜(品红色)和核(蓝色)标记的人活化T细胞的三维重建体积。横向堆叠(k)和双色叠加(l)的人类激活T细胞(j)在6 μm的深度范围内。m 人类激活T细胞的强度-体积图(n = 679),通过高斯拟合和它们的线性关系(灰色虚线与绿色阴影误差)显示平均直径7.99 μm(细胞,红色)和6.57 μm(细胞核,蓝色)。n 人类激活T细胞的N:C比值(n = 679)作为细胞体积的函数,表明平均比值为0.55。比例尺:10 μm(g),1 μm(k)。源数据以源数据文件的形式提供。

图5:通过LFC可视化STS处理Jurkat细胞的形态学变化。
去噪光场图像线粒体(a)和核(b)在一个没有STS处理的活的Jurkat细胞中。相应的插图显示放大的元素图像。这些LFC图像是>200个在相同实验条件下获得的细胞图像的代表。3D重建图像(c)和(a)和(b)中的细胞的焦堆图像(d)。虚线表明从周围线粒体中分割的核。分别用STS处理30(e),60(g),120(i),300(k)分钟的Jurkat细胞的3D可视化和它们相应的焦堆图像(f,h,j,l),显示整个细胞中碎片和浓缩的核分布。m每个STS处理期间显示凋亡细胞形态的细胞百分比。n每个STS处理期间细胞中微核的平均体积。o散点图显示每个STS处理期间每个细胞中单个微核与其质心的平均距离。距离为0μm的完整细胞核分别占处理0(即无处理)、30、60、120和300分钟的细胞总数的96%、83%、74%、69%和49%。p 每个STS处理期间(o)距离的平均值(虚线)和标准差(阴影),显示碎裂细胞核的分散度增加。每个组的样本量(m-p)为100。q 箱形图说明了在不同STS处理时间内(n=30个细胞/组),单个细胞内微核所包围的线粒体体积相对于微核和线粒体总体积的分布。箱子代表从第一四分位数到第三四分位数的数据。胡须代表1.5四分位距(IQR)值范围内的数据。箱子内的线和方块分别代表每组的中位数和平均值。菱形数据点代表数据的异常值。比例尺:10μm(a,b),5μm(d,f,h,j,l)。源数据以源数据文件的形式提供。
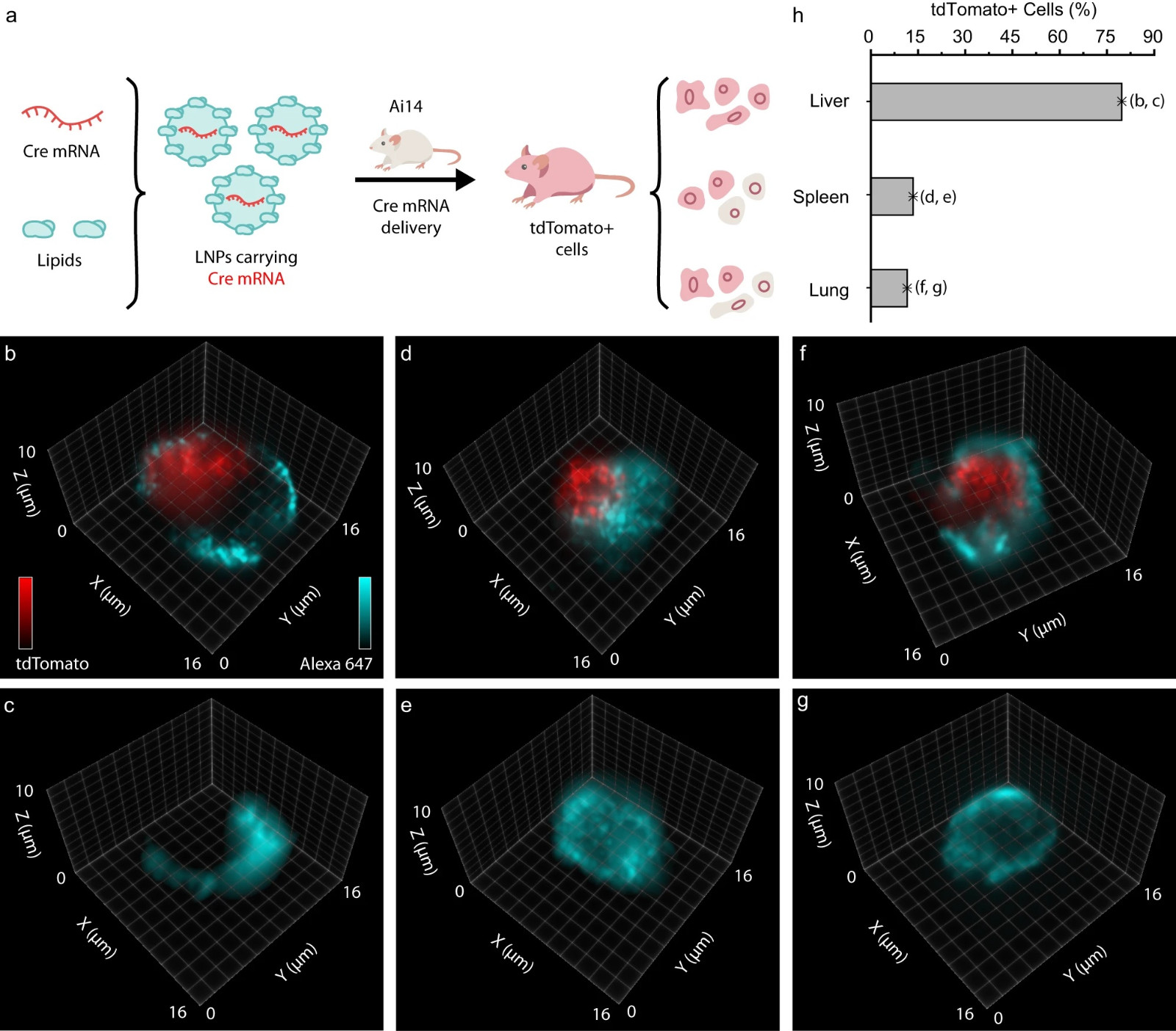
图6:在离体小鼠细胞中通过脂质纳米颗粒(LNP)传递检测Cre mRNA表达。
a LNP制备和传递到Ai14小鼠不同器官细胞的示意图。肝内皮细胞的3D可视化,其中(b)含有tdTomato表达,(c)不含有tdTomato表达。脾免疫细胞的3D可视化,其中(d)含有tdTomato表达,(e)不含有tdTomato表达。肺内皮细胞的3D可视化,其中(f)含有tdTomato表达,(g)不含有tdTomato表达。h 柱状图显示肝(n = 102)、脾(n = 316)和肺(n = 119)细胞中tdTomato+表达的百分比分别为79.41%、13.45%和11.39%。源数据以源数据文件的形式提供。
参考文献:
Hua, X., Han, K., Mandracchia, B. et al. Light-field flow cytometry for high-resolution, volumetric and multiparametric 3D single-cell analysis. Nature Communications 15, 1975 (2024). https://doi.org/10.1038/s41467-024-46250-7
Xuanwen Hua, Keyi Han, Biagio Mandracchia, Shu Jia等发表在期刊《自然通讯》上的 Light-field flow cytometry for high-resolution, volumetric and multiparametric 3D single-cell analysis (光场流式细胞术用于高分辨率、体积和多参数三维单细胞分析)文章,阐述了高3D分辨率、高通量和高灵敏性的光场流式细胞仪用于细胞生物学的应用潜力。2024-03-13相关仪器 -
免责声明
①本网刊载上述内容,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任
②若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi

-
 仪网通铜牌会员 第
7 年
仪网通铜牌会员 第
7 年泰初科技(天津)有限公司
认证:工商信息已核实
- 产品分类
- 品牌分类
- 电流/电压放大器
- Emulseo 表面活性剂
- 微流控进样泵
- 表面等离子体共振仪P4SPR
- 微流控传感器或流量计
- 微流控切换阀
- 微流控智能界面软件ESI
- 微流控OEM产品
- 微流控芯片
- 微流控PDMS芯片加工设备
- 微流控配件如导管、接头及适配器等
- 微流控实验用高速相机
- 微流控实验用光学显微镜
- 微流控3D定位系统
- 苏黎世(ZI)数字锁相放大器
- 细胞操控系统
- 数字ddPCR和单细胞分析
- (瑞士)瑞士苏黎世仪器
- (法国)法国Elveflow
- (德国)德国Femto
- (美国)美国CorSolutions
- (其它)爱尔兰Cellix
- (德国)德国Cetoni高精密注射泵
- (荷兰)荷兰Micronit微流控芯片
- (美国)美国SRS电子测量仪器
- (美国)美国Labsmith
- (法国)达尔文微流控
- (加拿大)加拿大Affinité
- (法国)Cherry Biotech
- (法国)法国BlackHoleLab
- (美国)化学X
- (美国)Microfluidic Fastec
- (美国)埃特蒙德
- (厦门)麦克奥迪
- (美国)Jun-Air
- (美国)美国SynVIVO
- (法国)法国Emulseo
- (美国)美国FlexCell
- (英国)英国Kirkstall
- (南开区)泰初科技
-
仪企号
 泰初科技(天津)有限公司
泰初科技(天津)有限公司
-
友情链接
-
手机版开启全新的世界m.yiqi.com/zt10926/