-
公司新闻
-
难溶性药物的溶出度测试系列一:表面活性剂(下)
发布:禄亘仪器设备(上海)有限公司浏览次数:232901 案例研究
为了理解表面活性剂在溶出介质中的应用,提出了以下案例研究。
1.罗氟司特
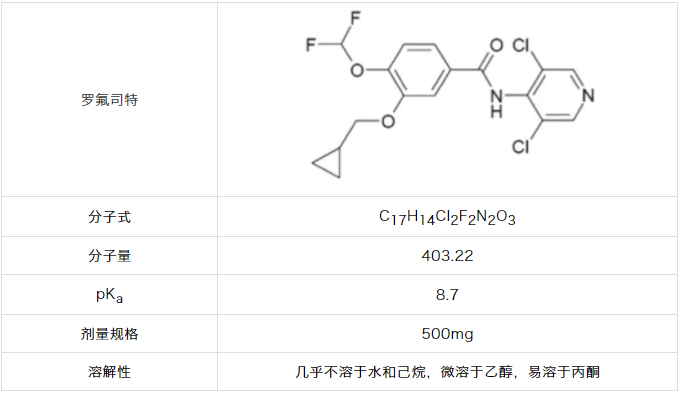
罗氟司特是一种弱酸,pKa值为8.74,溶解度依赖于pH值。在22℃时,罗氟司特在水中的溶解度为0.52-0.56μg/ml。4它的溶解度从中性pH约0.8μg/ml增加到pH10约35.8μg/ml。4
药物的溶解度在整个生理学范围内(pH1.2-7.5)不依赖于pH,但不能达到吸收条件,因此纯水性介质不适合用作溶出介质。FDA推荐的溶出方法(表1.1)是由pH6.8的磷酸盐缓冲液中1.0%的SLS组成的介质。
这种介质应该溶解大于溶解度(漏槽)的3倍,因此,500微克规格的罗氟司特能完全溶解。另一方面,罗氟司特的药品配方利用赋能技术和赋形剂来提高溶出度和生物利用度。5

表1.1 对于罗氟司特FDA推荐溶出方法1
2.芬戈莫德
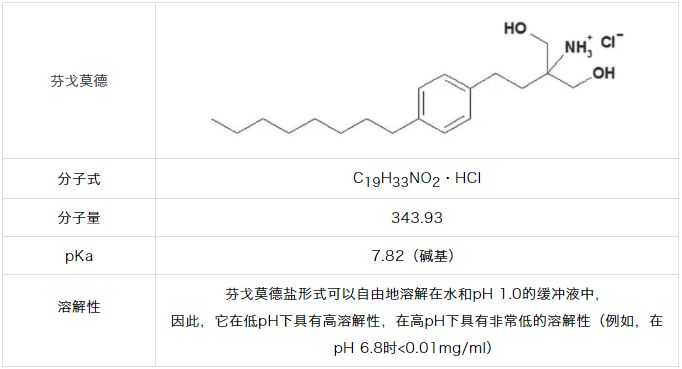
盐酸芬戈莫德在中性pH下溶解性很差,在酸性pH范围时溶解度较高大于100mg/ml。使用0.1N盐酸介质可提供>3×(漏槽条件),而不需要表面活性剂即可达到漏槽条件。然而,芬戈莫德具有吸附到包括溶出容器在内的各种表面的倾向,导致在溶出方法验证期间不完全回收。2,13为了达到完全的回收,使用0.2%SLS(w/w)已经被FDA使用和接受。这种情况代表了表面活性剂不是用于提高溶解度,而是用于促进实验条件下的回收的情况。

表1.2 FDA推荐的芬戈莫德溶出方法
3.拉莫三嗪
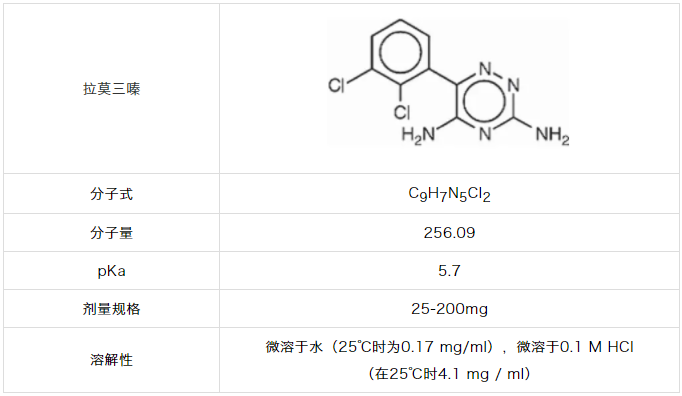
拉莫三嗪6在水中具有较差的溶解度,并具有一定的pH依赖性(图3)。拉莫三嗪在酸性介质中的溶解度较高,拉莫三嗪质子化,溶解度较高。3拉莫三嗪的ZG剂量是200mg,溶解到900ml中产生0.222mg/ml的浓度。为了达到理论的溶出状态(3×),所需的溶解度至少为0.222mg/ml×3即0.666mg/ml。任何溶解度超过0.666mg/ml的介质都可能需要在拉莫三嗪900ml的离体漏槽条件。
这种pH依赖性可用于开发溶出方法,这是在开发选择0.1N HCl作为溶出介质的拉莫三嗪片剂(常规和可咀嚼)中进行的(表1.3)。
然而,在开发拉莫三嗪缓释片的溶出方法的过程中,探索了模拟体内动态的现实方法,最初的酸相(胃),2小时后是pH6.8碱性(肠)。在中性和碱性pH下具有低溶解度,需要加入SLS以保持漏槽条件。后一种情况被用来模拟生物利用度。
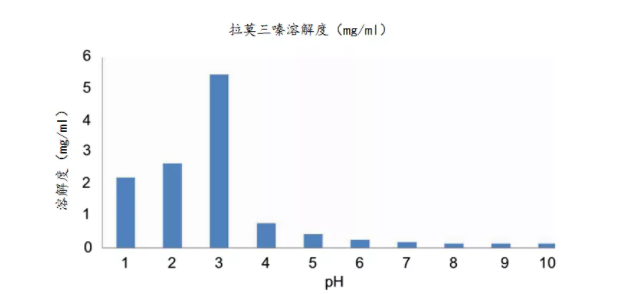
图3 拉莫三嗪在pH值范围内的溶解度
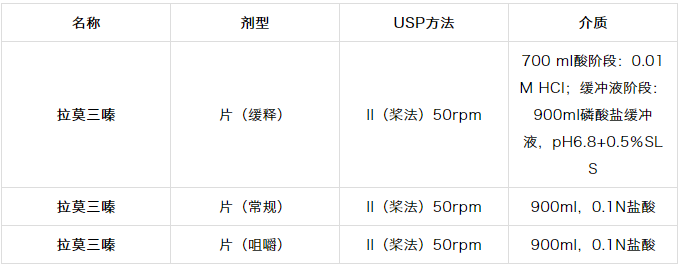
表1.3 FDA推荐的拉莫三嗪溶出方法
4. 他克莫司
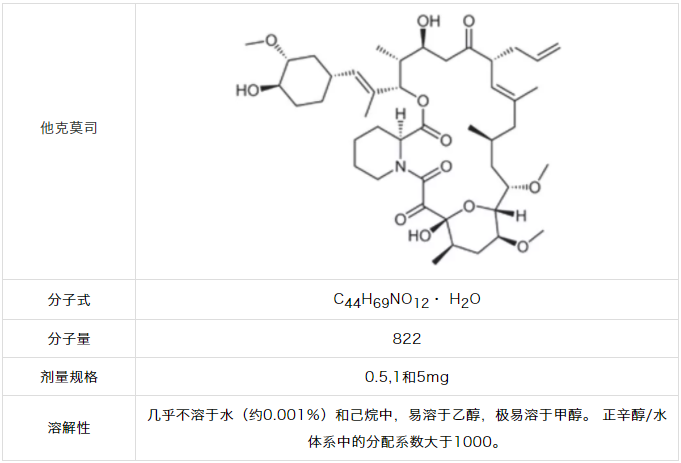
普乐可复速释胶囊中他克莫司的JD生物利用度为20-25%。7为了更好地区分制剂和稳定期间,需要完全释放药物。但他克莫司不溶于水,溶解度约为0.001%。尽管其溶解度差,但是ZD的剂量(5mg)可以溶解在标准溶出体积中,尽管溶出速率很慢。
更有问题的是他克莫司倾向于吸附到表面。8由于剂量低,这种吸附是有问题的;表面的小质量损失相对于总药物量损失很大。这导致他克莫司在容器表面固定不动,降低了可供分析的药物浓度。9因此,需要辅助剂来解决介质和表面吸附中的缓慢溶解速率。如表1.4所示,已经发现羟丙基纤维素解决这两个问题,它充当了表面活性剂/增溶剂。
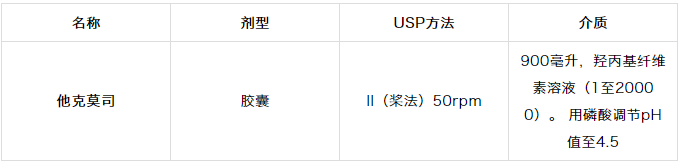
表1.4 FDA推荐的他克莫司溶出方法
5.胺碘酮
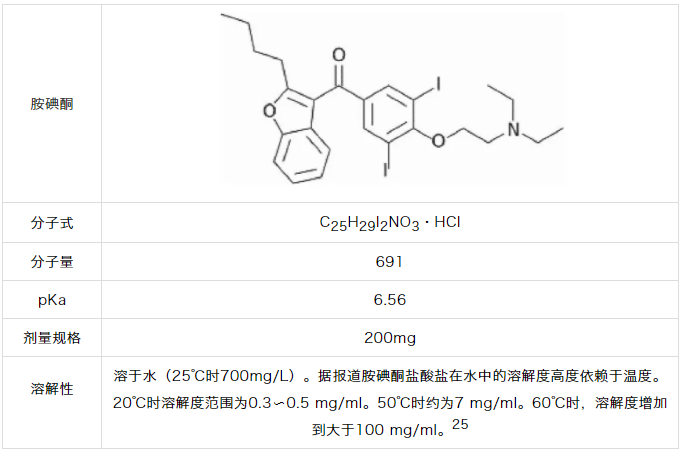
胺碘酮10具有较差的固有水溶性,导致API缓慢溶解。如表1.5所示,建议使用足量的表面活性剂。另外,胺碘酮具有吸附到表面11上的趋势,并且可能导致不完全的回收,使用表面活性剂可消除这个问题。
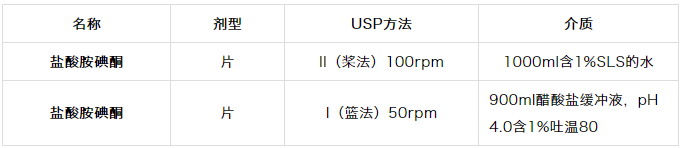
表1.5 FDA推荐的胺碘酮溶出方法
6.加酶
胶囊是zui受欢迎的固体口服剂型之一,这是由于制造和给药的便利性。明胶胶囊是使用最广泛,但在储存在醛和高湿度条件下存在交联的固有属性。明胶一旦交联,形成薄膜屏障,不允许明胶外壳破裂,从而在体外分析过程中限制内容物的释放。
Brown等人已经评估了明胶交联的真正的体内崩解作用。12使用闪烁照相调查技术,观察压缩和非压缩的对乙酰氨基酚胶囊的实际体内崩解时间。中等压力的胶囊在10分钟内崩解,而未受压的胶囊则为8分钟。这项研究证实,中等压力和无压力胶囊的体内崩解特性之间没有显著的差异。
Meyer等人13研究了暴露于甲醛的硬和软对乙酰氨基酚胶囊以引发明胶胶囊的交联。在USP溶出度测试条件下胶囊失败的体外溶解研究证实了交联。为了确定体内研究的实际影响,使用了24名未交联胶囊与交联胶囊之间的交叉生物等效性研究。这些发现导致人们接受了使用酶的第二级溶出测试。23
基于通过向溶出介质中加入蛋白水解酶获得的令人满意的溶出结果,在USP25中包括了二级溶出测试。24
目前USP35中的二级溶出度测试文本是:
对于不符合溶出指标的硬胶囊或软胶囊和明胶包衣片剂,重复如下测试。如果在个别专论中将含有pH小于6.8的介质的水定为介质,则可以使用与经纯化的胃蛋白酶的添加相同的介质,从而导致每1000mL含活性750,000单位或更少。对于pH为6.8或更高的介质,可以添加胰酶以产生不超过1750USP单位的蛋白酶活性/1000ml。
02 监管关注
对于不溶于或微溶于水的药品,建议使用表面活性剂如十二烷基硫酸钠。9表面活性剂的需求和数量应该是合理的,不过,一般建议指出水平不得超过2.0%。10FDA不鼓励使用水醇介质。9
USP指出溶出方法应该反映由于压力(光照,温度,湿度等)引起的药品“相关”变化。换句话说,它应该是稳定指示。另一方面,同一章节建议尽可能减少崩解的变异性。这两个陈述之间的平衡往往被忽视。到目前为止,FDA或USP没有限制使用任何ZD量的表面活性剂,但使用的任何量都需要符合上述标准。
参考文献:
1.Dissolution method: List of all Drugs in the Database. Available at <http://www.accessdata.fda.gov/scripts/cder/dissolution/dsp Search Results Dissolutions.cfm?Print All=1>[05 October 2014].
2.United State Pharmacopeia, USP 29/NF 24 <http://www.pharmacopeia.cn/>[05 October 2014].
3. Fliszar, K. A., Forsyth, R. J., Zhong, L., Martin, G. P. Effects of dissolved gases in surfactant dissolution media. Dissolut. Technol., 2005, 12(3), 6–10.
4. WO/2006/032676. Pharmaceutical compositions comprising roflumilast or the N-oxide of roflumilast. Altana Pharma.
5. Dietrich, R., Eistetter, K., Ney, H. Oral dosage form containing a PDE 4 inhibitor as an active ingredient and polyvinylpyrrolidone as excipient.US Patent, US 8431154 B2, 2013.6. Brittain, H. G. Profiles of Drug Substances, Excipients and Related Methodology, vol. 37. Salt Lake City, UT: Academic Press, 2012.
7. Australian Public Assessment Report for Tacrolimus, Prograf-XL, PM-2008-03783-3-2,Australian government—Department of health and ageing—therapeutic goods administration <https://www.tga.gov.au/pdf/auspar /auspar-prograf-xl.pdf>[05 October 2014].
8. Jacobson, P. A., Johnson, C. E., West, N. J., Foster, J. A. Stability of tacrolimus in an extemporaneously compounded oral liquid. Am. J.Health Syst. Pharm., 1997, 54, 178–180.
9. Trissel, L. A. Handbook on Injectable Drugs, 9th ed. Bethesda: American Society of Pharmacists, 1996.
10. Weir, S. J., Myers, V. A., Bengtson, K. D., Ueda, C. T. Sorption of amiodarone to polyvinyl chloride infusion bags and administration sets. Am. J. Hosp.Pharm., 1985, 42(12), 2679–2683.
11. Formulations containing amiodarone and sulfoalkyl ether cyclodextrin.US Patent, US 6869939 B2.12. Brown, J., Madit, N., Cole, E. T., Wilding, I. R., Cadé, D. The effect of crosslinking on the in vivo disintegration of hard gelatin capsules. Pharm.Res., 1986, 15(7), 1026–1030.
2021-08-31 -
免责声明
①本网刊载上述内容,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任
②若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi






