-
解决方案
-
FluorCam叶绿素荧光成像技术FAQ
发布:北京易科泰生态技术有限公司浏览次数:3091.叶绿素荧光测量有哪些主要技术?有没有哪种仪器可以同时实现这些测量技术?
答:叶绿素荧光技术有三种主要测量技术路线:
1)PAM脉冲调制式叶绿素荧光技术:测量PAM荧光淬灭动力学曲线
2)直接激发式(非调制式)叶绿素荧光技术:测量OJIP快速荧光诱导曲线
3)双调制式叶绿素荧光技术:时间分辨率可以达到1微秒,用于测量QA-再氧化动力学曲线、S-state、单周转或多周转饱和光闪快速荧光动力学等
4)其它叶绿素荧光测量技术:如激光诱导(LIF)叶绿素荧光测量、太阳光诱导叶绿素荧光(Solar-induced Chlorophyll Fluorescence,SIF)测量等(参见本条后面介绍)
目前,能够同时完成上述1)3)三种荧光动力学曲线测量的仪器只有FL6000双调制叶绿素荧光仪、 FluorCam封闭式荧光成像系统和FKM多光谱荧光动态显微成像系统。而由于OJIP快速荧光动力学曲线和QA-再氧化动力学曲线对技术的特殊要求,对这两种曲线的成像分析更是只有FluorCam封闭式荧光成像系统和FKM多光谱荧光动态显微成像系统能够实现。

左图: FL6000双调制叶绿素荧光仪;中图:FluorCam封闭式荧光成像系统;右图:FKM多光谱荧光动态显微成像系统
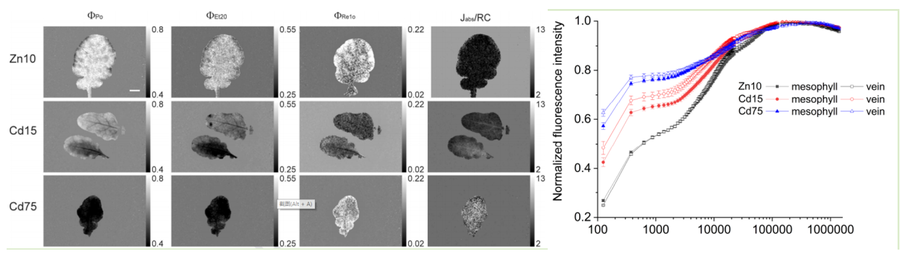
超积累植物鼠耳芥在Cd/Zn处理后的OJIP成像图与OJIP动力学曲线(Morina, 2020)

超积累植物鼠耳芥在Cd/Zn处理后的PAM荧光淬灭显微成像图与QA-再氧化动力学分析(Morina, 2020)
易科泰生态技术公司提供叶绿素荧光技术全面解决方案,除传统的PAM技术、OJIP测量技术、双调制技术外,还提供叶绿素荧光高光谱成像和激光诱导(LIF)叶绿素荧光高光谱成像技术方案,不仅可以解析植物叶绿素荧光二维异质性分布,还进一步从高光谱纬度解析叶绿素荧光光谱特性,并成像分析Fr(叶绿素荧光红色峰值)、Ffr(叶绿素荧光远红峰值)、Fr/Ffr、F735/F700(与叶绿素浓度呈直线相关)及基于叶绿素荧光不同峰值(红色峰值Fr和远红峰值Ffr等)的叶绿素荧光参数。LIF叶绿素荧光高光谱成像技术可实现大田叶绿素荧光近地遥感测量。
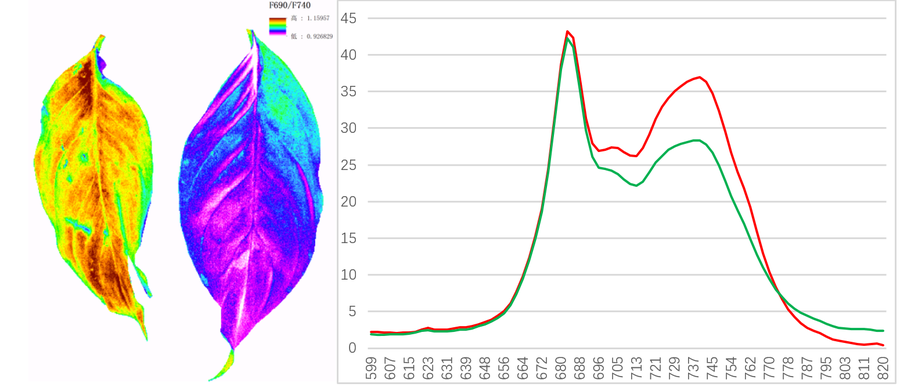
左图:叶绿素荧光参数Fr/Ffr成像;右图:叶绿素荧光光谱(易科泰光谱成像与无人机遥感研究中心提供)
2.测量叶绿素荧光的光源为什么具备两种以上颜色?什么颜色的光源?
答:在FluorCam叶绿素荧光成像系统中一般推荐的光源组成是这样的:
5)测量光:红光
6)光化光:红光+白光或红光+蓝光
7)饱和脉冲光:白光或蓝光
在脉冲调制技术中,测量光主要的作用是测量小荧光F0。而在激发F0时,要求光反应中心不产生电荷分离和热耗散。在激发叶绿素荧光的可见光波段中,红光波长长,能级ZD,能够确保叶绿素分子被激发到较低的激发态。而蓝光等波长较短的光在激发叶绿素荧光时则可能造成热耗散。因此红光ZJ的荧光测量光源。
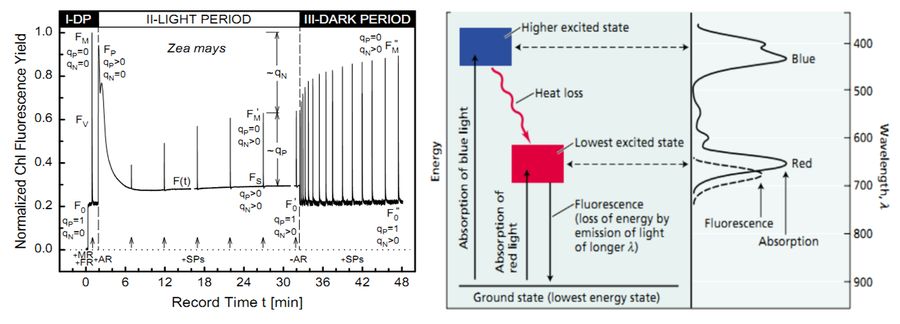
左:荧光淬灭测量过程中qN与qP的变化;右:红光和蓝光激发叶绿素荧光的差别
在光化光和饱和光的选择上,则主要考虑荧光激发效率问题,这与植物/藻类样品中光合色素的吸收光谱是密切相关的。如下图可见,红光和蓝光对应叶绿素吸收峰,激发叶绿素荧光效率ZG,也可用于研究植物/藻类对不同光质的响应。白光是连续光谱,可模拟自然光,同时兼顾各种光合色素。红光能级较低,一般不推荐作为饱和脉冲光源。FluorCam也可定制其他波段光源针对特定样品,尤其是藻类样品,比如590 nm琥珀光、530nm青光、505nm绿光等。
两种或两种以上光化学光的另一个优势是,可进行不同光质光和效率研究及光生物学研究,如下图所示(引自Sander W. Hogewoning等,Blue light dose-responses of leaf photosynthesis, morphology, and chemical composition of Cucumis sativus grown under different conbinations of red and blute light. Journal of Experimental Botany, 2010)
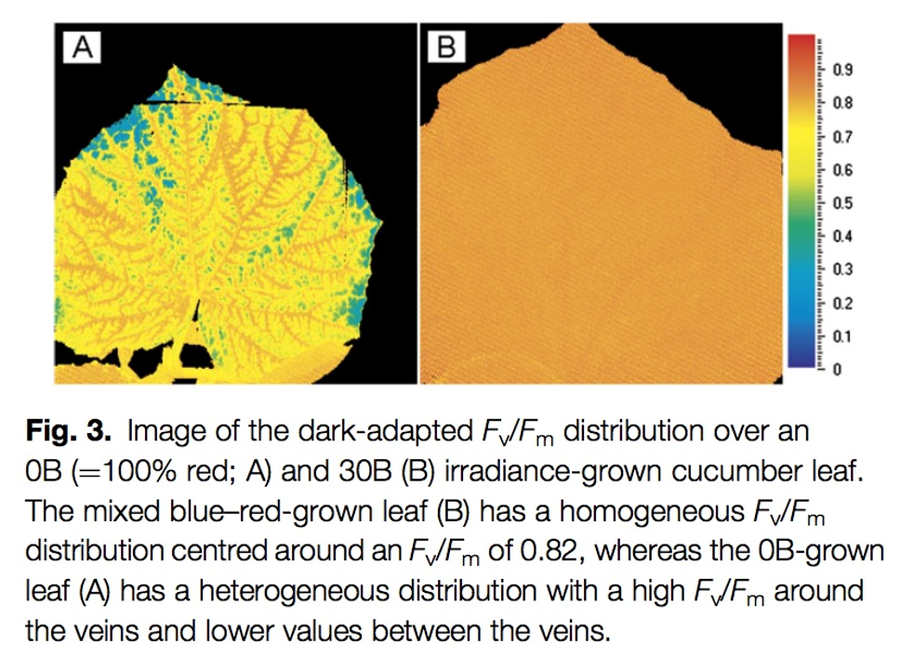
3.FluorCam有哪些PAM脉冲调制测量功能与参数?
答:FluorCam主要的PAM脉冲调制测量功能和获得的参数如下:
Fv/Fm:测量参数包括F0,Fm,Fv,Fv/ Fm等
Kautsky诱导效应:F0,Fp,Fv,Ft_Lss,QY,Rfd等荧光参数
荧光淬灭分析:F0,Fm,Fp,Fs,Fv,Fv/ Fm,QY,F0’,Fm’,Fv’/ Fm’,NPQ,qP,Rfd,qN,qL等
光响应曲线:F0,Fm,Fv/ Fm,不同光强下QY,Fv’/ Fm’,NPQ,qP,ETR等
具体参数可参阅下表:
参数符号概念描述
参数符号
概念描述
Fo
暗适应后的小荧光
Fo_Dn
暗弛豫过程中的小荧光,D代表暗弛豫过程,n代表测量过程中第n次饱和脉冲获得的数据,下同
Fo_Ln
光适应过程中的小荧光,L代表光适应过程,下同
Fo_Lss
光稳态小荧光,ss为steady-state缩写,代表稳态,下同
Fm
暗适应后的ZD荧光
Fm_Dn
暗弛豫过程中的ZD荧光
Fm_Ln
光适应过程中的ZD荧光
Fm_Lss
光稳态ZD荧光
Fp
光适应过程初始阶段的峰值荧光
Ft_Dn
暗弛豫即时荧光
Ft_Ln
光适应即时荧光
Ft_Lss
光适应稳态荧光
Fv
暗适应后的可变荧光,=Fm-Fo
NPQ_Dn
暗弛豫过程中的非光化荧光淬灭,=(Fm-Fm_Dn)/Fm_Dn
NPQ_Ln
光适应过程中的非光化荧光淬灭,=(Fm-Fm_Ln)/Fm_Ln
NPQ_Lss
光稳态非光化荧光淬灭,=(Fm-Fm_Lss)/Fm_Lss
qP_Dn
暗弛豫过程中的光化学荧光淬灭,=(Fm_Dn−Ft_Dn)/Fm_Dn−Fo_Dn
qP_Ln
基于“Puddle”模型的光适应过程中的光化学淬灭,=(Fm_Ln−Ft_Ln)/(Fm_Ln−Fo_Ln)
qP_Lss
基于“Puddle”模型的光稳态光适应光化学淬灭,=(Fm_Lss−Ft_Lss)/(Fm_Lss−Fo_Lss)
qL_Ln
基于“Lake”模型的光适应过程中的光化学淬灭,=qP_ Ln×(Fo_ Ln /Ft_ Ln)
qL_Lss
基于“Lake”模型的光稳态光适应光化学淬灭,=qP_Lss×(Fo_Lss /Ft_Lss)
QY_Dn
暗弛豫过程中的实际光量子效率,=(Fm_Dn−Ft_Dn)/Fm_Dn
QY_Ln
光适应过程中的实际光量子效率,=(Fm_Ln−Ft_Ln)/Fm_Ln
QY_Lss
光稳态实际光量子效率,=(Fm_Lss−Ft_Lss)/Fm_Lss
QY_max(Fv/Fm)
暗适应后的ZD光量子效率,=Fv/Fm
Fv/Fm_Ln
光适应过程中的ZD光量子效率,=(Fm_Ln−Fo_Ln)/Fm_Ln
Fv/Fm_Lss
光稳态ZD光量子效率,=(Fm_Lss−Fo_Lss)/Fm_Lss
Rfd_Ln
光适应过程中的荧光衰减率,用于评估植物活力,=(Fp−Ft_Ln)/Ft_Ln
Rfd_Lss
稳态荧光衰减率,用于评估植物活力,=(Fp−Ft_Lss)/Ft_Lss
ETR
电子传递速率,ETR=QY_Lss×PAR×0.5×0.84(PAR吸收率),PAR吸收率可通过PAR吸收测量模块进行修正
4.主要叶绿素荧光参数的值域范围是多少?相互关系是怎么样的?
答:一般来说,Fm ≥ Fp ≥ Ft ≥ Fs ≥ Fo,Fo’ ≥ Fo,Fm’ ≤ Fm,暗弛豫(actinic light关闭后)的Fm ≤ 暗适应的Fm,Fp和Fm’没有严格高低关系。
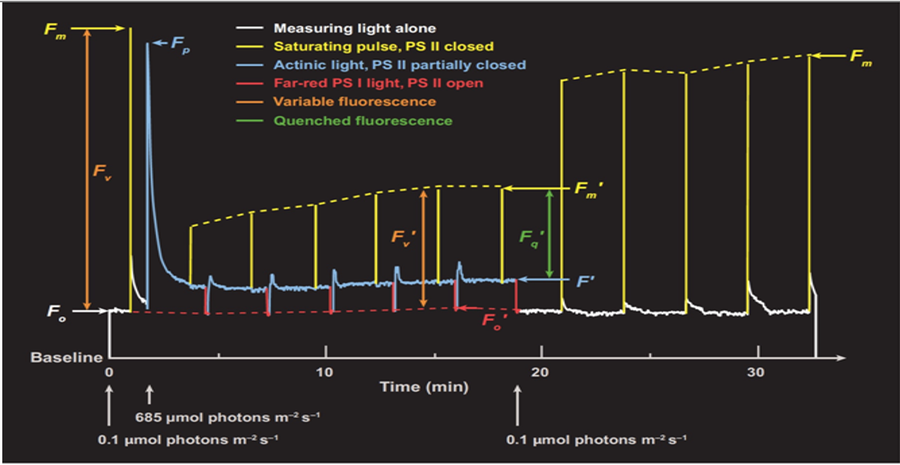
ZD光化学效率Fv/Fm或QYmax值域0 – 1。但实际上,在理想状况下存在上限。:
C3植物:0.83 - 0.84 (Bjorkman and Demmig 1987)
C4植物:0.78 (Pfundel 1998)
藻类:常低于0.7 (Trissl and Wilhelm 1993)
这一上限在不同文献中存在差异,但一般来说,C3植物在实验中对照组数据要争取大于0.8,ZG不能高于0.86。
实际光化学量子效率或量子产额QY或ΦPSII值域0 − 1,≤ Fv/Fm,一般随Actinic light升高而降低。
Rfd值域为0 − ∞ ,一般在0 – 6。
qN、 qP、 qL值域为0 – 1。
NPQ值域为0 − ∞,一般在0 – 4。因此,有的文献中会使用NPQ/4这一参数来对其归一化。
5.FluorCam软件中的荧光参数似乎与文献中的有些差异,一般文献中使用的参数对应FluorCam软件中的哪个参数?
答:软件中为了便于识别与区分,与文献中的一般描述有所差异。一般文献中提到的参数在FluorCam软件中的显示如下:
文献中的参数FluorCam软件中的参数

软件参数后缀L代表光适应过程,D代表暗弛豫过程, ss为steady-state缩写,代表稳态。Lss即为光稳态。
对于光适应条件下的荧光参数,文献中都默认使用的是光稳态时的对应参数。FluorCam软件中特别以Lss后缀加以区分。而其他的L1、L2、D1、D2等对应的参数则可以表征表示光适应或暗弛豫从起始到稳态的变化过程。
在光响应曲线Light Curve测量中,由于每一个光强梯度均达到光稳态,因此参数后缀均为Lss,不同数字表示不同的光强梯度。
QY在中英文文献中可能会有多种不同的表述方法,但实际上其代表的意义是相同的,即光适应下的真实光能转化效率,计算公式也是相同的。

6.光适应下的小荧光F0’是如何测量的?
答:小荧光 F0是在暗适应条件下测量得到的,这时PSII光反应中心处于完全开放状态(qP=1)。而在光适应下PSII光反应中心处于部分关闭的状态(0<qP<1),这时候怎么可能测量小荧光呢?
以前,由于技术限制,所有叶绿素荧光仪器都不能直接测量F0’。1997年,Oxborough和Baker提出了一个F0’的估算公式:
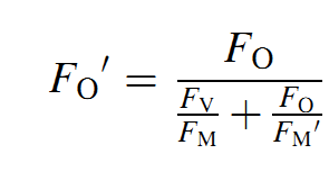
之后的一系列研究证明,这个公式估算得到的数据是可信的。即使是现在,大部分没有明确说明的叶绿素荧光仪器依然是使用这个公式进行估算。
但这个数据终究不是直接测量得到的,在很多光合研究中是无法代表。随着LED技术的进步,FluorCam则通过配备专用的远红光源板来对F0’进行实测。这是利用了远红光只会激发PSI而不激发PSII的特性。在光适应刚刚结束,光化光关闭时,立刻照射远红光,使PQ库氧化,强制PSII达到完全开放的状态,从而对F0’进行实测。

从另外一个方面说,没有配备远红光源的叶绿素荧光仪或者荧光成像仪都是不能实际测量F0’的。同时,有些荧光成像仪即使配备了远红光源,但由于其远红光源没有与PAM脉冲调制测量程序联动,也不能实际测量F0’。
7.叶绿素荧光测量前为何要进行暗适应?必须要进行暗适应吗?
答:暗适应是为了测ZD荧光Fm和小荧光Fo。
植物/藻类在经过一定的暗适应后,QAZD程度被氧化,光反应中心完全“开放”,此时仪器运行程序则自动发出测量光,才以测得小荧光F0。此测量光极小,不能引起光化学反应。也可不进行暗适应直接测量,运行Fv/Fm程序,测量得到的QYmax=QY(实际光量子效率)。
8.已经有叶绿素荧光仪了,是否还有必要买叶绿素荧光成像仪?
答:有必要。叶绿素荧光仪为点测量,获得众多荧光参数值,单次测量难以反映样品的整体特性,可多次测量取平均值等。比起荧光仪,叶绿素荧光成像仪有以下不可替代的优点:
•数据结果可以是整个样品的平均值,可反映样品的整体特性,避免样品差异造成的误差;也可以通过ROI选区工具自动或手动选择不同区域进行分析
•成像图能够全面反映整株植物、叶片、藻类群体等的不同位置荧光强度变化与分布,即光合作用生理生态及胁迫的异质性分布状态。
•可测量叶片、果实、麦穗、大型藻/微藻、整株植物乃植物冠层等各种样品。
•可同时测定几十、甚上百株个样品。
•能够在显微水平研究叶绿体或藻类细胞。
•尤其适用于环境胁迫早期植物不同部位光合活性的变化规律、突变体不同部位的光合功能差异等研究。
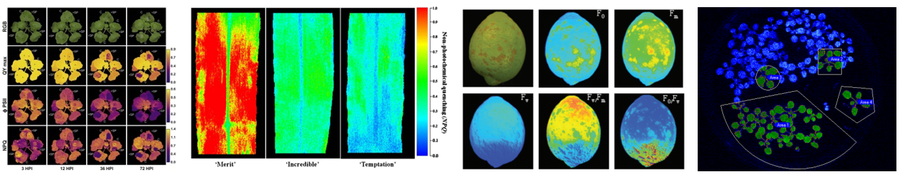
9.叶绿素荧光测量时如何选择光质?
答:叶绿素荧光测量主要针对叶绿素a,叶绿素a的两个光谱吸收波峰在蓝紫光波段和红光波段,因此选择蓝光、红光或者白光(复合光)一般均可。其中注意,蓝藻测量时尽量选择红光。
10.叶绿素荧光测量必须在植物活体上测量吗?
答:原则上,叶绿素荧光测量因尽量对样品活体原位检测。条件不允许时可以测量离体叶片,但尽量在活体状态下进行暗适应处理,测试时离体时间不超过15-20分钟。但具体情况也要看样品在离体后失水影响的具体情况,有些样品则在短时离体后就会萎蔫卷曲,如水稻,而有些样品可耐受长时间离体,如一些革质叶片。离体检测尽量使用湿纱布等包裹叶梗,如需光下转运可使用两片湿滤纸夹住叶片,避免叶片失水,影响测量结果。
11.NPQ为负值应当如何解决?
答:一般是测量参数设置不当造成的,可尝试将饱和脉冲光适当调大或光化光适当调小。有些是样品特性造成的,这种情况可尝试更换光质。
12.是否能获得ETR?如何获得ETRmax?
答:叶绿素荧光测量仪运行LC1~3程序,叶绿素荧光成像运行LightCurve程序,均可获得ETR。ETRmax则需使用sigma plot等工具软件,拟合光响应曲线RLC来获得。(参考文献:Ralph P J, Gademann R. Rapid light curves: A powerful tool to assess photosynthetic activity[J]. Aquatic Botany, 2005,82(3):222-237. 更多参考文献可联系易科泰获取)
13.叶绿素荧光成像时对样品有何要求?
答:要求样品无任何遮挡,尽量平铺,整株植物成像则对同一水平高度的部分进行检测。大型藻可有水湿润但水不要没过样品。背景尽量单纯并且为黑色或者非反光材质。避免使用锡纸、塑料板等反光物品。测量时一般选用叶片正面,而当叶片背面首先遭受病虫害时,则也可对背面进行检测。
14.我的不同处理组样品是分开成像的,那在写论文时如何将图片放在一起对比?
答:属于同一实验且需要保存的成像图,必须将其彩色标尺调整为相同的区间。具体步骤如下:
1)点选软件result界面右下方Group color前√ ,同一类参数将使用同一彩色标尺。
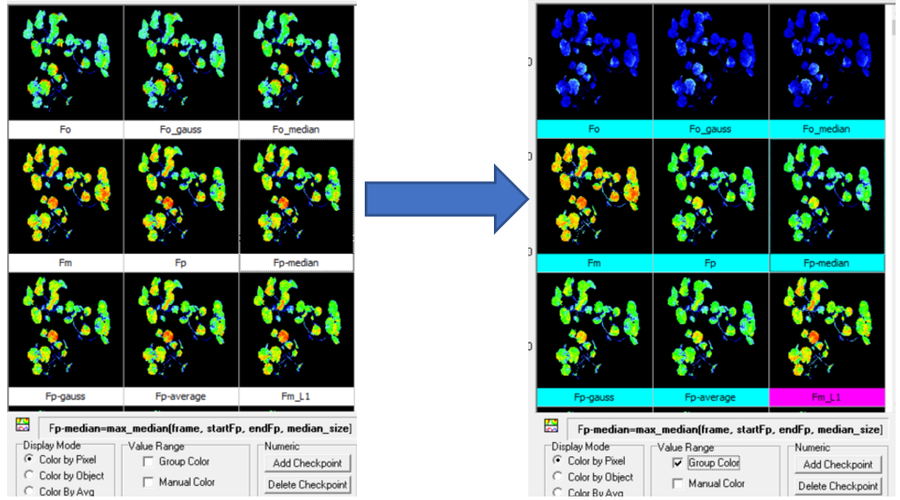
2)点选右下方Manual color前√ ,手动设定标尺范围,右键保存成像图。

3)不同处理样品重复以上步骤,所有样品同一参数的成图像标尺范围必须设定一致。
4)设定标尺范围的标准:符合对应参数的理论范围,比如Fv/Fm、QY不超过0-1,NPQ一般不超过0-4等;为了突出成像效果,可缩小标尺范围,但要确保成像图上主要的像素点在这一范围内
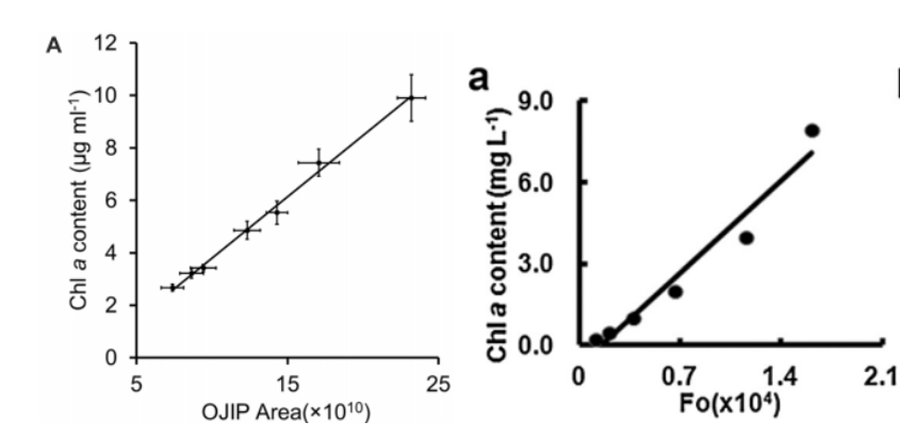
15.可以通过FluorCam评估叶绿素浓度吗?
答:有三种方法可以评估叶绿素浓度:
1)小荧光F0、ZD荧光Fm和OJIP快速荧光参数Area都与叶绿素浓度有正相关性,有很多相关的文献进行过探讨(Chen,2021,2017)。但由于叶绿素荧光参数同时与光合状态有关,因此在使用上应小心。
2)通过PAR吸收模块实现。通过这个模块测量计算的NDVI植被归一化指数,与叶绿素浓度成正相关,这一参数本身就广泛用于大田遥感普查、森林生态监测等。同时成像图能够反映叶绿素浓度异质性。

3)通过紫外激发多光谱荧光成像实现。测量的F690/F740与叶绿素浓度为负相关。目前已有研究其用于作物氮素营养状况评估。
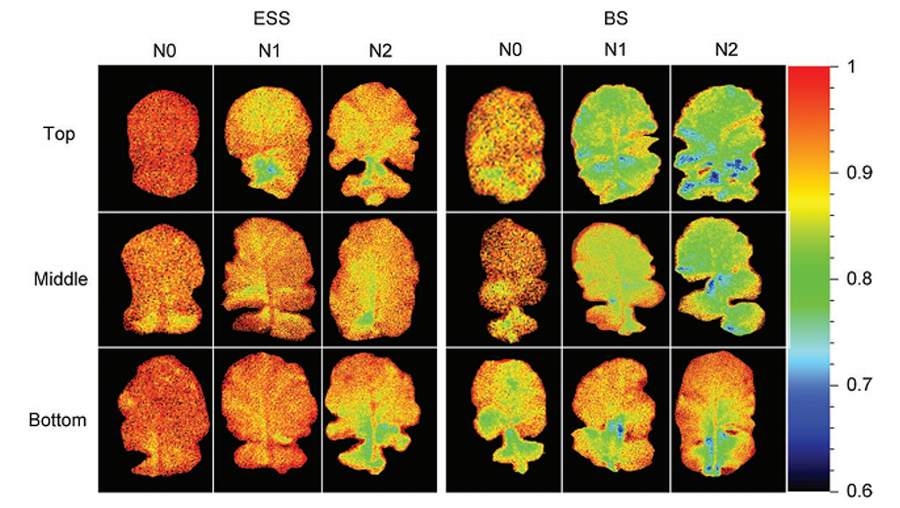
浙江大学应用FluorCam多光谱荧光成像技术进行油菜氮素营养快速评估(Sun,2020)
16.在使用FluorCam软件导出数据时,使用Frame numeric还是 numeric average更好?
答:通常,我们建议使用numeric average。以计算Fv/Fm为例,Frame numeric是指先计算每个像素的Fv/Fm,然后再除以像素数求得区域平均Fv/Fm。而numeric average,则是先获得整个区域的平均F0、平均Fm,再以此计算Fv/Fm。如果分析过程中,样本信号强,噪点很少,两种方式的差异不明显。如果样本荧光信号弱,并且存在噪点,则选择numeric average更好。
17.FluorCam显示pixels overflow是什么意思?对数据有何影响?怎么修正?
答:高灵敏度CCD相机检测荧光的范围为0-4096个单位,高分辨率CCD相机则在0-65536。超出该信号就会警示pixels overflow即信号溢出。在开始实验测量前,您需要在live窗口调整shutter和sensitivity,以及设置适合的光强。在打开flash情况下调整shutter和sensitivity使暗适应后的样品荧光值处于较低数值(此时显示的荧光值其实F0)。我们通常建议高灵敏度CCD相机设置到500-1000,高分辨率CCD相机设置到5000-10000。不同的植物需要不同的设置,建议预实验摸索。
18.Shutter和sensitivity如何影响成像质量?为了获得ZJ效果,建议哪些组合设置?
答:详细的设置方法参考说明书。简短来说,shutter即快门时间,同时还控制测量光的持续时间,一般不超过20或30ms ,sensitivity即灵敏度。两者越高,荧光信号值越高,太高则超出正常F0的范围。Shutter一般建议设置10-20us,ZD不超过33us。Sensitivity越高信噪比越低,建议一般不超过50%。
19.盐胁迫水稻幼苗非光化学荧光淬灭成像:视频中动力学曲线随着胁迫加重而上升说明了什么,还有怎么去分析此类型的动力学曲线?
答:动力学曲线随胁迫加重上升一般是因为胁迫导致PSII光化学反应活性降低,光能转化效率低,更多的光能以荧光的形式散失,所以导致荧光信号增强。
荧光动力学曲线的分析通常有两种方式:一是比较不同样品在暗适应-光适应-暗弛豫3个阶段的荧光强度变化的差异,考察PSII对光强变化的适应性和可塑性以及每个阶段的PSII的活性及电子传递状况。分析结果都是定性描述,定量分析仍需借助计算值;另外一种分析方式是将动力学曲线上的特征性荧光强度(如Fm_Ln,n代表第几次脉冲)作为变量,和计算值(如Fv/Fm)一起输入到数学模型中,从而筛选出能够反映胁迫程度的特征参数。后者可参考以下论文:
龙燕, 马敏娟, 王英允,等. 利用叶绿素荧光动力学参数识别苗期番茄干旱胁迫状态[J]. 农业工程学报, 2021, 37(11):8.
20.叶绿素荧光测量技术与光合仪的区别?
答:两者都是研究植物和藻类光合作用的有效工具,但是侧重不同。
光合仪主要测量植物的宏观参数,如光合速率、蒸腾速率、气孔导度、胞间CO2浓度等,以评估衡量植物光合作用的强度和能力,并标配或可选配微气候控制如光、温、湿、CO2模块。
叶绿素荧光不仅能反映光能吸收、激发能传递和光化学反应等光合作用的原初反应过程,而且与电子传递、质子梯度的建立及ATP合成和CO2固定等过程有关,是研究植物光合作用的“探针”。
两者结合测量在植物光合生理研究中可以有效互补,可广泛应用于衡量植物生长状况,不同胁迫处理对植物光系统的影响,评价生态系统碳收支与气候变化的相互关系,植物光系统对变化响应等方面。
21.蓝藻光合参数的测定
答:由于蓝光无法激发蓝藻PSII主要的天线色素藻胆素,只能激发叶绿素,而蓝藻中PSI中的叶绿素要多于PSII,这会使PQ库部分氧化,所以需要选择蓝光以外的激发光源,如UV365nm、cyan470nm、green530nm、orange625nn。
2022-06-10相关仪器 -
免责声明
①本网刊载上述内容,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任
②若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi

-
 仪网通银牌会员 第
9 年
仪网通银牌会员 第
9 年北京易科泰生态技术有限公司
认证:工商信息已核实
- 产品分类
- 品牌分类
- (其它)捷克Lightigo
- (美国)美国Veris Technologies
- (波兰)波兰E-Test
- (其它)冰岛Star-Oddi
- (捷克)捷克EMS
- (其它)捷克PSI
- (德国)德国PyroScience
- (法国)法国Yellowscan
- (美国)美国MicaSense
- (丹麦)丹麦loligo
- (瑞士)瑞士MSR
- (奥地利)METOS
- (意大利)意大利希思迪
- (奥地利)奥地利Pessl
- (加拿大)加拿大Regent
- (其它)欧洲 Bio Instruments
- (奥地利)奥地利VSI
- (芬兰)GrainSense
- (浦东新区)ADC Bio
- (其它)捷克FluorCam
- (德国)德国UGT
- (其它)捷克Workswell
- (美国)美国Sable
- (海淀区)北京易科泰
- (芬兰)芬兰Specim
-
仪企号
 北京易科泰生态技术有限公司
北京易科泰生态技术有限公司
-
友情链接
-
手机版开启全新的世界m.yiqi.com/zt3042/





























