-
产品文章
-
一种可测量Dox药物区室暴露的体内纳米传感器
发布:北京心联光电科技有限公司浏览次数:152测量不同组织对药物的反应非常关键,尤其是对于有剂量限制性毒性的药物,如可介导心脏毒性的多柔比星(doxorubicin),但临床前测量药物暴露通常具有破坏性。美国及以色列研究人员Jackson D. Harvey等使用可植入的光学纳米传感器,可在手术植入后无创、快速量化多柔比星在活生物体组织中的暴露情况。DNA功能化的单壁碳纳米管对多柔比星产生应答,近红外荧光发生大而均匀的偏移。在缓冲液和血清中、细胞内以及单个纳米管表面进行测量,发现多柔比星可不可逆地结合到DNA包裹的纳米管上,但并没有取代DNA。将纳米传感器整合到可植入膜中,可实现体内累积式检测多柔比星的暴露。将装置植入不同的区室(如皮下和腹膜腔内),实现了对注射入腹膜腔的多柔比星的实时、微创检测以及区室特异性测量。微创且可靠的体内药代动力学测量表明,该技术适用于临床前药物发现。文章以“An in Vivo Nanosensor Measures Compartmental Doxorubicin Exposure”为题发表于Nano Letters。
背景
临床前模型和患者中,治liaoxiao果评估和毒理学分析仍受药物药代动力学的实时瞬时监测限制。针对特异性组织的药物暴露测量对于理解药物毒性和zhiliao窗很重要。对于有剂量限制性毒性(dose-limiting toxicity)的药物,尤其有必要了解暴露和终生总暴露情况。临床前测量方法通常具有破坏性,需要解剖,且药物生物分布量化所需的终点分析(end point analysis)需要在每个时间点处死多个动物,因此亟需快速、简便的测量方法。
有严重剂量限制性毒性的一类癌症药物是蒽环类药物(anthracyclines),包括柔红霉素(daunorubicin)、多柔比星(doxorubicin,Dox)、表柔比星(epirubicin)、伊达比星(idarubicin)和戊柔比星(valrubicin)。多柔比星已成为最广泛使用的化疗药物之一,但由于剂量限制性的心脏毒性(累积且不可逆),给药受到极大限制,且要密切监测给药情况。根据临床经验,终生剂量550 mg/m2时,心脏毒性发生率约7.5%。多柔比星通常为静脉注射(IV)给药,某些情况下(如转移性卵巢癌)也可以高剂量给药至腹膜。组织特异性监测可实时评估特定解剖部位的药物分布,心脏组织附近或内部的累积情况可提供患者暴露于多柔比星的精确信息,并最zuizhong能够更好控制并预防心肌病。
蒽环类药物通过嵌入与DNA相互作用,使DNA扭曲变形从而阻止复制或其他基本细胞功能,可停止癌细胞分裂,但对正常分裂的细胞也可能具有高度毒性。分子生物学中DNA嵌入剂被广泛用于可视化DNA(如溴化乙锭等)。一些污染物如多环芳烃(PAHs)也被认为是具有致癌潜力的嵌入剂,快速光学检测PAH可用于环境监测或其他毒理学应用。
单壁碳纳米管(SWCNT)是一种具有独特DNA结合特性的纳米材料,已被用于开发原位光学和电子传感器。单链DNA可与单壁碳纳米管共价结合制备碳纳米管胶体溶液。单壁碳纳米管在近红外范围内有高度稳定的光致发光(荧光),可穿透活组织,且对局部介电环境高度敏感。DNA包裹的纳米管(DNA-SWCNT)有类似的环境响应性,并已应用于多种分析物的检测,如脂质、烷基化化疗药物、细胞表面和可溶性蛋白质以及microRNA等。DNA-SWCNT传感器已用于体内分析物的检测,包括活性氧、microRNA、癌症的蛋白生物标志物等。
已知多柔比星可结合PEG化脂质包裹的碳纳米管,PEG化脂质用作药物递送载体。DNA包裹的纳米管与两亲性表面活性剂相互作用时,可通过碳纳米管光致发光变化来识别。鉴于多环芳烃和多柔比星等DNA嵌入剂对碳纳米管的强亲和力,推测利用纳米管的发光应答,可实现对生物环境(如体内)中这些物质的监测。
本文研究了DNA嵌入剂对碳纳米管光学性质的影响及其在体内的应用。发现DNA嵌入剂与碳纳米管表面结合会引发碳纳米管发射和激发波长红移,这可能是由于电荷载流子屏蔽。多柔比星可以剂量依赖性引起ssDNA包裹碳纳米管红移及猝灭,在缓冲液和血清条件下的快速动力学都是如此。机制研究发现,包裹的DNA没有被置换,约180个多柔比星分子不可逆地结合到平均长度166nm的DNA包裹纳米管上。此外单个纳米管复合物可在缓冲液和血清条件下检测多柔比星,在很大程度上可概括平均整体应答情况。体外测试了三种形式的植入式装置:两种水凝胶(琼脂糖和藻酸盐)和可热封的半透膜。使用半透膜制备的植入设备发现传感为累积应答。通过手术植入小鼠腹腔,可对注射的多柔比星进行快速、微创的光学检测。zuihou在腹膜隔开的两个部位分别植入了装置,给药多柔比星后,发现不同解剖位置的应答显著不同,表明药物没有穿过这一薄层组织。
结果
01-DNA嵌入剂与DNA包裹碳纳米管的相互作用
用已知DNA嵌入剂(溴化乙锭、SYBR green和Hoechst 33258)测试DNA包裹的碳纳米管,通过嵌入后的荧光变化测量DNA含量,评估纳米管发光应答情况。化疗药物多柔比星(Dox)作为一种有效的抗快速分裂细胞药物,部分缘于它对DNA的亲和力。通过胺封端的聚乙二醇(PEG,1000MW)与NHS活化的1-pyrenebutyric acid反应,合成PEG和芘的共轭物(pyrene-PEG,图1a)。每种试剂都引起碳纳米管发光红移(图1b,c)。大多数药剂的发射强度都有不同程度降低,1μM多柔比星和溴化乙锭的降低幅度zuida(图1b,d)。该浓度约等于潜在的生理浓度,即先前研究表明患者血液中多柔比星浓度可达0.92μm。鉴于多柔比星光学传感器在临床上的应用潜力,值得进一步探究。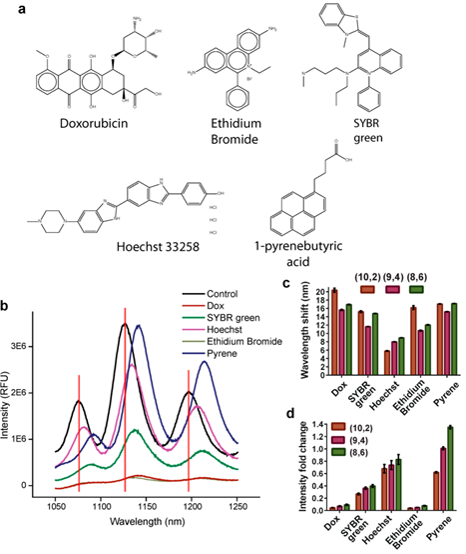
图1 DNA嵌入剂与DNA包裹纳米管的相互作用。(a)5种DNA嵌入剂的结构。(b)添加1μM化合物后DNA包裹纳米管的发光谱。(c)加入1μM化合物后,三个手性的波长相对于缓冲液对照组的偏移。(d)加入1μM化合物后三种手性强度相对于对照的倍数变化。
02-DNA-纳米管对多柔比星应答的量化分析
稀释实验发现,多柔比星浓度500nM-50μM,孵育4h后,大多数纳米管手性表现出剂量依赖性红移(图2a)。除(9,4)的500nm外,所有手性的检测限为5μM多柔比星。5μM多柔比星孵育可引发纳米管发光淬灭60-80%,0.5μM多柔比星可引发20-50%淬灭(图2b)。基于发光强度方面,所有手性的灵敏度可达500nm。引入多柔比星后,测量纳米管发光应答的动力学。波长偏移和强度猝灭应答很快,大部分发生于样品添加和首次测量之间。
已知由于与血清蛋白的静电相互作用,碳纳米管发光会出现非特异性红移。因此探究在复杂生物溶液如血清中定量检测多柔比星的可能性。剂量反应实验观察到剂量依赖性红移(图2c)及强度猝灭(图2d),与仅使用缓冲液情况相比,灵敏度降低了约1个数量级:除(9,4)(5μM)外的所有手性在50μM发生波长偏移,强度变化发生在5μM。鉴于多柔比星可与血清蛋白结合,可能因此降低了游离药物与纳米管传感器的结合。
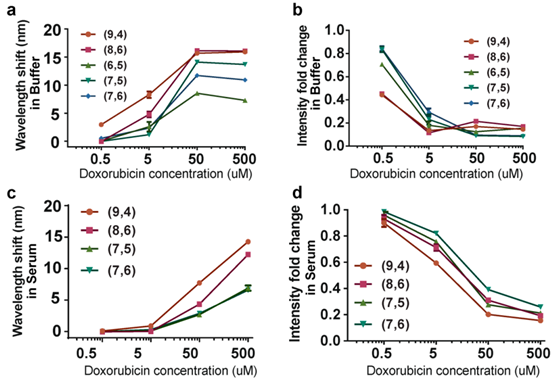
图2 纳米管传感器对Dox反应的敏感性和动力学。(a)5种纳米管手性发射带中心波长随Dox浓度的变化。(b)5种纳米管手性的发射强度随Dox浓度的变化。(c)血清中5种纳米管手性发射带中心波长随Dox浓度的变化。(d)血清中5种纳米管手性的发生强度变化随Dox浓度的变化。
淬灭机理研究方面,缓冲液条件下添加多柔比星可见DNA-纳米管复合物发生聚集,用缺乏金属纳米管的单壁碳纳米管制剂实验也发生聚集,因此聚集可能不是猝灭的原因。随后评估多柔比星是否通过与吸附核苷酸碱基的竞争相互作用来取代纳米管表面的DNA。但荧光标记的DNA-SWCNT复合物的置换实验表明,包裹的DNA没有被多柔比星置换。
03-量化与DNA包裹纳米管结合的多柔比星
已知质量的(GT)15包裹纳米管加入500μM多柔比星,对照加入等体积缓冲液。孵育后离心,通过吸收光谱分析上清液中的多柔比星含量,估算出1μg的(GT)15包裹纳米管可结合0.95μg多柔比星,少于磷脂-PEG包裹纳米管的负载量(4:1)。接下来通过离心洗涤试图洗掉结合的多柔比星,洗涤三次,每次洗涤后提取上清液测量吸光度。比较每次洗涤上清液的吸光度与标准曲线,计算出通过洗涤从纳米管表面去除了约0.35μg多柔比星。因此0.6μg多柔比星与1μg (GT)15包裹纳米管强结合,足以抵抗洗脱,且对比实验发现洗涤对纳米管发光谱几乎没有影响。本实验样品中碳纳米管的平均长度为166nm,估计平均质量为3×10-19 g。因此一个纳米管约有180个多柔比星分子强结合。综上所述,0.6μg多柔比星几乎不可逆地结合到1μg (GT)15包裹纳米管上,引发纳米管发光变化,其他结合不太强的多柔比星似乎不会进一步引发光学变化。
04-缓冲液、血清及细胞条件下评估单纳米管对多柔比星的应答
将DNA包裹纳米管在赖氨酸包被的玻璃底板上孵育10min,随后洗涤并更换缓冲液。730nm激发,荧光显微镜成像,明显可见单个纳米管(图3a)。近红外高光谱成像获得单个(9,4)纳米管的光谱(图3b)。用缓冲液(对照)或终浓度50μM多柔比星孵育10min后再次获得光谱,计算每个单个纳米管的发射波长偏移。发现多柔比星处理产生11.6nm±1.5nm的总波长红移(图3c)。单个纳米管的平均光谱(11.6nm)与总体光谱(15.6nm)信号变化接近。全血清中,引入多柔比星后单个(9,4)纳米管的红移平均幅度为7.7±0.9nm(图3d),可良好概括整体测量情况。
(GT)15包裹纳米管与RAW 264.7鼠巨噬细胞细胞系孵育过夜,洗涤三次以去除细胞表面吸附的纳米管。白光图像为正常的细胞形态(图3e),宽带近红外图像显示大多数细胞内有斑点,即含纳米管的小泡(图3f)。500μM多柔比星或缓冲液(对照)处理细胞,孵育1h,随后高光谱显微镜测量(9,4)纳米管发光。证实纳米管中心波长与每个细胞内的总荧光强度无关。500μM多柔比星处理时,每个细胞的平均红移约14nm(图3g)。已知DNA-纳米管复合物通过内吞作用或吞噬作用内化,纳米管仍位于细胞内的小泡中,且细胞活力不受纳米管影响。因此细胞中纳米管对多柔比星的反应与上述血清测量结果几乎相同(图2c)。
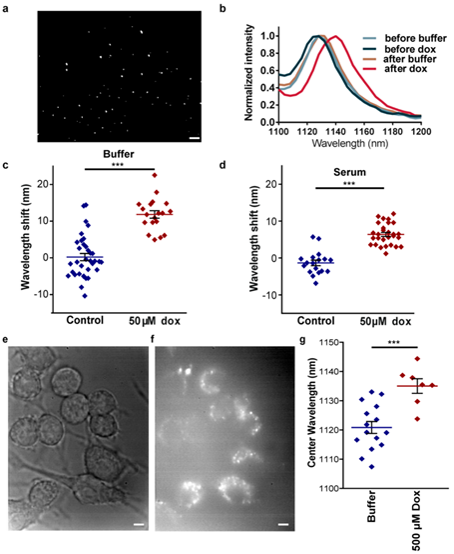
图3 单纳米管对Dox的反应。(a)玻璃板上碳纳米管的近红外发光图像。(b)用缓冲液(对照)或50 μM Dox处理时所有单纳米管光谱的复合光谱。(c)单个纳米管用50μM Dox或仅缓冲液处理时的波长偏移。每个点代表单个纳米管。中心线为平均值。(d)全血清中,缓冲液或50μM Dox处理时单个纳米管的波长变化。(e)1000×放大的玻璃表面巨噬细胞。(f)e中细胞730 nm激发下的宽带近红外发光。(g)缓冲液或500μM Dox处理,单个细胞内所有纳米管的中心波长。
05-构建可植入式多柔比星传感器
测试了三种不同材料。首先是琼脂糖凝胶,已知该凝胶可携带纳米管复合物且不会减弱其光致发光。体外凝胶复合物对多柔比星的传感应答与无凝胶包裹的纳米管复合物非常相似,处理10min后动力学、最大偏移和强度猝灭不受凝胶包裹影响。可逆性方面,多柔比星处理过的纳米管琼脂糖凝胶(约20μL)用50mL去离子水透析,重复三次,zuihou一次过夜进行。纳米管发光红移没有因透析而改变,与之前实验中无法洗掉多柔比星一致。另一种水凝胶藻酸盐中,同样观察到对多柔比星的红移和淬灭反应。zuihou是多孔膜,将纳米管溶液热封于其中。体外剂量反应评估发现,多柔比星浓度高于5μM引发红移,但强度没有淬灭到其他材料的程度,某些纳米管手性产生的亮度高于基线(引入Dox前)。在全血清体外测试封装了DNA-纳米管的膜时,发现类似现象,但最大淬灭发生在50μM而不是5μM,符合血清中敏感性降低的结论。
测试了5μM附近及以下浓度,发现小于1μM时发射波长没有偏移。但在可以检测到红移的较低浓度下会发射强度淬灭。约5μM以上浓度时,强度恢复到与未处理对照组相当的水平。此外强度变化比例可控制改变juedui强度的潜在因素,如不同组织类型中不均匀的光吸收及散射。测量了纳米管(9,4)和(8,7)的强度比率,发现比率测量可将检测阈值提高到50-500nM。假设药物总质量相同情况下,植入装置对大体积低浓度多柔比星长期孵育的反应,与小体积高浓度孵育的反应一致。制备载有纳米管的膜植入装置,10m/5μM和1mL/50μM多柔比星(总质量29μg)分别孵育过夜,1mL缓冲液和1mL/5μM多柔比星(2.9μg)作对照。结果发现对照表现如预期,5μM多柔比星引发红移和最大淬灭,50μM进一步红移同时强度恢复(图4a)。实验组用1mL/5μM多柔比星再次引发红移和最大淬灭。10mL/5μM产生的光谱与1mL/50μM几乎相同(图4a)。评估了(9,4)纳米管的中心波长(图4b)和强度(图4c),发现在统计上没有差异。因此植入的纳米传感器以累积方式检测多柔比星。
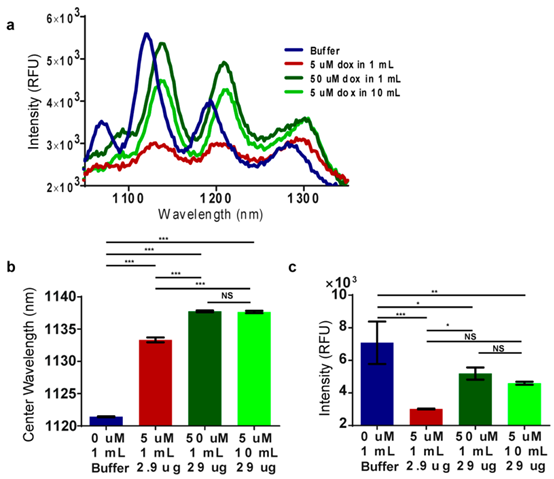
图4 多柔比星的检测为累积式。(a)不同孵育情况下可植入膜装置中DNA悬浮纳米管的发射光谱。(b)(9,4)中心波长。(c)a和b中数据的强度。
06-体内植入纳米传感器的功能性评估
通过手术将装载纳米管的膜植入活小鼠腹膜腔。动物苏醒并能行走1h后,异氟醚再次麻醉。用定制的激光探针装置透过皮肤测量植入的碳纳米管荧光,装置由730nm激光器和耦合InGaAs阵列检测器的光谱仪组成。测量后,腹膜内给药1mL/500μM多柔比星,再次允许小鼠苏醒并走动。30min后,麻醉测量纳米管荧光。发现注射多柔比星产生了预期的红移和强度猝灭(图5a)。
连续测量以评估注射后立即结合的多柔比星的动力学。重复之前的植入和多柔比星给药实验,同时在多柔比星注射前后连续监测(8,6)纳米管,数据采集时间0.5s。观察到最初的猝灭(图5b),随后约4min时出现红移(图5c)。未发现皮肤损伤、痛苦迹象等实验损伤。
体内检测阈值方面,腹腔注射缓冲液、5μM、50μM或500μM多柔比星。发现(9,4)手性在50μM和500μM浓度下都有显著红移,但5μM浓度下没有(图5d),(8,6)手性中也有类似变化。检测到50μM多柔比星,而不是5μM,与全血清中数据一致。
zuihou研究了植入碳纳米管传感器是否可实现区室特异性测量。通过手术将两个碳纳米管装置分别放置于腹膜腔中、皮肤与腹膜间。定制的全动物近红外临床前高光谱成像仪评估放置情况,皮肤下可见一个植入装置(图5e)。730nm宽带近红外成像显示两个植入物的纳米管发光。腹腔注射多柔比星,监测植入装置荧光强度(图5f)。宽带成像显示腹膜腔中发生淬灭,但皮下没有(图5f)。收集全动物高光谱数据,皮下植入物注射前后光谱完全相似,腹膜植入物因发光强度过低无法辨别。使用光纤探针连接的近红外光谱仪体内测量发现,与腹膜外的装置相比,腹膜内的装置发生了很大程度红移及淬灭(图5g)。离体测量实验证实了体内观察到的红移(图5h)。两种传感器的应答差异表明,本实验条件下多柔比星主要局限于腹膜内。
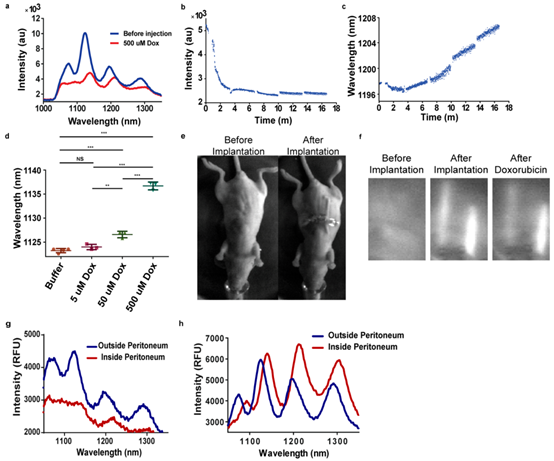
图5 体内不同解剖部位多柔比星的检测。(a)注射前和腹腔注射1μL Dox 1.5min后,植入膜装置的发光谱。(b)在0 min腹腔注射1 mL Dox后实时测量的(8,6)手性装置强度。(c)腹腔注射后实时测量(8,6)中心波长。(d)注射后(9,4)纳米管的中心波长。(e)手术前(左)和植入传感器后(右)的小鼠图像。(f)传感器植入前(左)、植入后(中)和注射500μM Dox后小鼠的宽带近红外发光。左边的装置植入腹腔,右边的装置位于皮肤和腹膜间。(g)探针测量的皮肤下(蓝色,腹膜外)和腹膜内(红色)装置的发光谱。(h)实验后离体皮肤下(蓝色,腹膜外)和腹膜内(红色)的发射光谱。
结论
通过将DNA-纳米管制成可植入设备,通过红移和淬灭应答,实现了体内定量检测多柔比星及相关化合物,可帮助解决患者的剂量监测问题。即使在全血清、活细胞和体内复杂环境中,纳米管对多柔比星的光学应答也相当稳定。试图去除多柔比星也没有消除引发的红移。鉴于多柔比星对患者的毒性是累积的且不可逆的,因此临床应用中,累积传感行为很重要。传感装置可由微创手术植入。热腹腔化疗(HIPEC)程序中,植入式传感器也可参与,在活体动物或患者中对多柔比星进行位点特异性测量,提供更精确的zhiliao。在实验模型系统中,也可通过研究多柔比星在活生物体中的到达情况,辅助药代动力学研究。可能会极大帮助了解癌症对多柔比星的抗性是细胞内在过程还是外在过程。
参考文献:Harvey, J. D. , et al. "An in Vivo Nanosensor Measures Compartmental Doxorubicin Exposure." Nano Letters 19.7(2019).2022-05-19相关仪器 -
免责声明
①本网刊载上述内容,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任
②若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi

-
 仪网通铜牌会员 第
2 年
仪网通铜牌会员 第
2 年北京心联光电科技有限公司
认证:工商信息已核实
- 产品分类
- 品牌分类
-
仪企号
 北京心联光电科技有限公司
北京心联光电科技有限公司
-
友情链接
-
手机版开启全新的世界m.yiqi.com/zt70569/








