-
产品文章
-
通过二维硅纳米平台进行活体全过程监测热化疗
发布:北京心联光电科技有限公司浏览次数:183Adv. Sci.:通过二维硅纳米平台进行活体全过程监测热化疗:宏观指导和长期微观精确成像策略
背景
纳米诊断医学已广泛应用于大量疾病的诊断和治疗。其中zuiremen的研究点之一是肿瘤的诊断和治疗。近年来,为了延长纳米诊疗制剂的在循环系统中存留的时间,增强其肿瘤富集度,提高癌症的治疗效果,表面活性剂和稳定剂表面功能化的纳米诊疗制剂得到了广泛的发展。选择具有亲水部分和疏水部分的类表面活性剂化疗药物 5-氟尿嘧啶(5-Fu)通过静电相互作用引入初始二维硅纳米片(Si NSs)。该策略不仅可以提高Si NSs的生物稳定性和理化稳定性,还可以延长循环寿命5-Fu是一种很有前景的嘧啶类似物,也是一种低毒的胸苷酸合成酶抑制剂。通过抑制癌细胞中DNA和RNA的合成来治疗许多实体肿瘤。因此,5-Fu可发挥双药协同抑制DNA和RNA合成的作用,提高化疗效果。在本篇文章中,厦门大学的赵庆亮团队及第四军医大学的马恒团队合作,利用一种简便快速的化学脱锂和低温剥落的方法制备得到二维纳米硅片,通过结合kangai药物5-Fu,实现了高稳定性多功能二维纳米诊疗制剂的构建。在该工作中,由北京心联光电科技有限公司提供OCTA成像与数据分析技术支持,成果以“Intravital Whole-Process Monitoring Thermo-ChemotherapyVia 2DSilicon Nanoplatform: A Macro Guidance andLong-Term Microscopic Precise ImagingStrategy"为题发表在《ADVANCED SCIENCE》上。
结果与讨论
01-5-氟尿嘧啶硅纳米片(5-Fu-Si NSs)的合成与表征
首先,通过一种简单的方法耦合化学脱锂合成2D Si NSs。然后,层状Si NSs被PVP封端液体剥离。随后,根据先前的研究,通过经典的物理静电力吸附机制合成了二维5-Fu-Si NSs。简而言之,5-Fu 的化疗药物可以吸附在二维Si NSs的表面。以增加其生物相容性、稳定性,并延长在体内的循环时间。从而提高了联合治疗的效率。为了进一步确认5-Fu-Si NSs 的形成,使用透射电子显微镜(TEM)和动态光散射(DLS)来测量和观察5-Fu-Si NSs 的形态和直径,如图1a、c所示 .
如图 1c 所示,去离子水中单分散2D 形状 Si NSs 的平均直径约为120 nm。此外,通过高分辨率 TEM(FEI,Talos 200s)在图 1b 中观察到 Si NSs 的清晰晶格。代表性 TEM 图像显示 5-FuSi NSs 是单分散的,均匀尺寸为 128.9 ± 3.5 nm(图 1a),分布相对较窄(图 1c)。受益于 5-Fu 修饰,Si NSs 分布更均匀,DLS 尺寸更适合生物医学应用。 5-Fu-Si NSs 的元素映射表明 C、N、O、Si 和 F 元素成功地封闭在5-Fu-Si NSs 内(图 1e)。此外,FT-IR 光谱证实了配位键的形成(图 1k)。如图 1k 所示,5-Fu-Si NSs 在 3121.30 cm-1 处表现出 N─H 特征峰,在 1719 cm-1 处表现出 C=O(羰基)峰,表明 5- Fu分子和Si NSs。 Si NSs 的表面电荷为负。并且5-Fu 的表面电荷为正。这进一步证明了 5-Fu 分子和 Si NSs 之间存在静电相互作用。同时,DLS证实的5-Fu-Si NSs的Zeta电位集中在-18.60 Mv(图1d),这使得整个系统成为一个相对纳米的系统,可以避免RES的吸附和吞噬作用。此外,高分辨率 TEM 能量色散光谱 (TEM-EDS) 映射显示 Si NSs 中 Si 元素的均匀分布(图 1j)。 Fu元素在5-Fu-Si NSs中的含量为2.90%。(图 S3a,支持信息)。基于上述结果,我们成功合成了片状结构的 5-Fu-Si NSs。
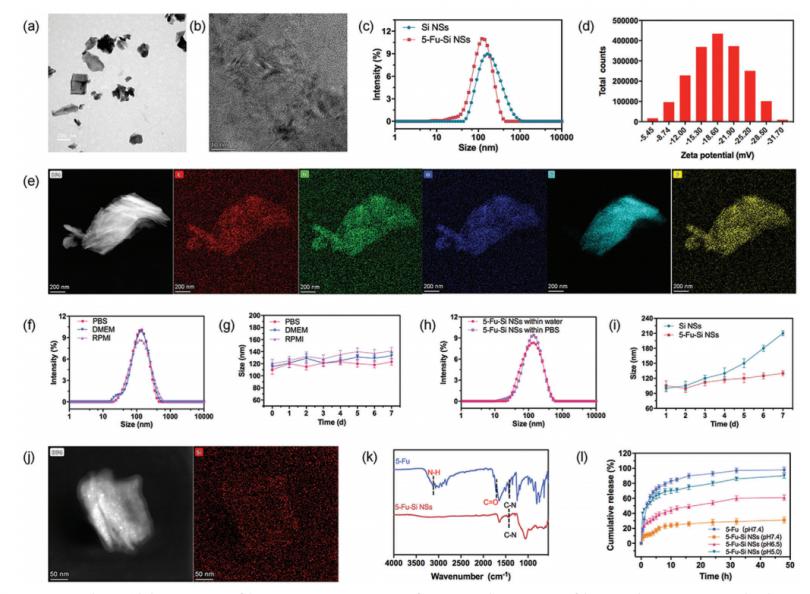
图1. a) 5-Fu-Si NSs的TEM图像。b) Si NSs晶格的TEM图像。c)直径分布和5-Fu-Si NSs。d) 5-Fu-Si NSs的Zeta势。e)分散在水中的5-Fu-Si NSs TEM-EDS成像。f)直径分布5-Fu-Si NPs分散在含有10% FBS和RPMI的PBS DMEM培养基中24 h. g10%胎牛血清和RPMI培养基培养7天。h)分散于水和PBS中的5-Fu-Si NSs的直径分布。i)直径分布Si和5-Fu-Si NSs在PBS中分散7天。j)分散在水中的Si NSs TEM-EDS成像。k) 5-Fu-Si nsss的FT-IR光谱。l)累积5-Fu和5-Fu- si nsss在pH 7.4、6.5和5.0下在37°C下的释放。02-体外药物装载和释放行为
此外,Si NSs 具有高比表面积的二维片状结构。 Si NSs 的物理特性使其具有很强的负载能力。这对药品的包装和运输非常有帮助。因此,选择 Fu 作为药物模型来评估 Si NSs 的负载能力。通过将 Fu 与 Si NSs 混合,Fu 通过弱相互作用力吸附到 Si 表面,根据公式(1)计算出的负载容量(LC)为 30.03%。优异的给药能力将有利于肿瘤区域释放更多的药物,对进一步的化疗起到至关重要的作用。考虑到肿瘤组织的特性具有低酸度和较高的氧化还原电位,药物递送系统必须在肿瘤环境中保持有效。
为了验证 5-Fu-Si NSs 的 pH 响应行为,利用 PBS 介质的不同 pH 值来模拟健康的人体生理条件和肿瘤细胞环境情况。接下来,计算了在不同 pH 条件下从 5-Fu-Si NSs 释放的 Fu 量。如图 1l 所示,5-Fu-Si NSs 显示出显着的 pH 依赖性释放行为。 Fu的释放量随着pH值的降低而逐渐增加。有趣的是,在 12 小时时,5-Fu-Si NSs 显示出显着的 pH 依赖性释放行为。当pH值接近肿瘤微环境(酸性pH 6.5和5.0)时,Fu的累积释放分别为≈47.33%和≈71.43%。与中性pH(pH 7.4)条件(模拟正常生理环境)相比,其累积释放量仅为≈25.32%(图1l)。这种现象可归因于 Si NSs 和 5-Fu 分子之间的静电相互作用消失,pH 值从 7.4 降低到 5.4。因此,我们的策略可以预期延迟药物在健康生理条件下释放并在被肿瘤细胞摄取之前保持完整的分层纳米结构。
03-5-Fu-Si NSs 的细胞毒性和热化疗分析
接下来,在进一步研究生物医学应用之前,纳米材料的低毒性是其临床转化的关键因素。首先通过 MTT 测定评估 Si NSs 的细胞毒性。 U87-MG 细胞的活力保持在 94.27 ± 6.1% 以上,显示出良好的生物相容性,即使 Si NSs 的浓度达到 200 µg mL-1(图 2a)。 然而,在与相同浓度的 5-Fu-Si NSs 孵育 24 小时后,细胞活力下降到 67.45 ± 3.3%。 这些结果显示了化疗中有效的肿瘤细胞杀伤能力,接下来,在进一步研究生物医学应用之前,纳米材料的低毒性是其临床转化的关键因素。首先通过 MTT 测定评估 Si NSs 的细胞毒性。 U87-MG 细胞的活力保持在 94.27 ± 6.1% 以上,显示出良好的生物相容性,即使 Si NSs 的浓度达到 200 µg mL-1(图 2a)。 然而,在与相同浓度的 5-Fu-Si NSs 孵育 24 小时后,细胞活力下降到 67.45 ± 3.3%。 这些结果显示了化疗中有效的肿瘤细胞杀伤能力,这是浓度依赖性的(图2a)。 5-Fu是一种临床kangai药物,对癌细胞有很好的杀伤作用。
有趣的是,在相应浓度下,联合激光组(Si NSs 加激光和 5-Fu-Si NSs 加激光组)的细胞活力与未使用激光的组相比急剧下降,表明热化学疗法的协同作用更多的是细胞-杀死比单一化疗有效(图2b)。 808 nm激光(1.0 W cm−2)照射5分钟后,Si NSs加激光和5-Fu-Si NSs加激光组的杀伤效率分别急剧下降至60.86 ± 6.20%和31.48 ± 4.8%(图) 2b)。为了进一步研究,分别使用 Calcein-AM(绿色荧光)和 PI(红色荧光)对活细胞和死细胞进行染色。在与 5-Fu-Si NSs 孵育 24 小时和激光照射(808 nm,10 分钟)后,如图 2c 所示,对照组(Si NSs)显示出明显的绿色荧光,表明 Si NSs 的毒性较低。相比之下,联合PTT组(Si NSs加激光和5-Fu-Si NSs加激光)中的细胞显示出明显的红色荧光,表明热化疗联合治疗引起广泛的癌细胞死亡并具有优越的细胞杀伤效果。
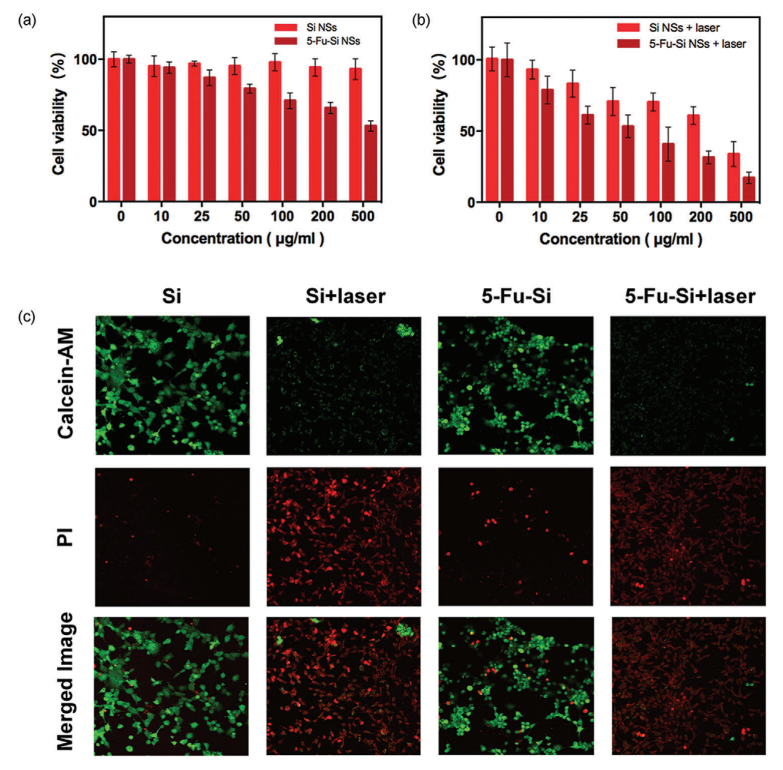
图2. a) Si NSs和5-Fu-Si NSs作用于U87-MG细胞12 h后的细胞活力呈浓度依赖性。b) Si NSs +激光和5-Fu-Si NSs +激光处理U87-MG细胞12 h后,浓度为依赖的细胞活力。c) Calcein-AM(绿色,活细胞)和PI(红色,死细胞)染色U87-MG细胞的荧光图像,评价5-Fu-Si nsss不同处理的热化疗效果。
04-光声和光热效应的体外评价
基于上面显示的 5-Fu-Si NSs 的光吸收和低毒性,我们进一步评估了 5-Fu-Si NSs 作为造影剂增强 PA 成像和同时作为光敏PTT剂杀死肿瘤。如图 3a、b 所示,PA 信号强度与 5-Fu-Si NSs 浓度呈正相关,显示出强烈的浓度依赖性。为了进一步评价5-Fu-Si NSs在体内的肿瘤光热效应,与去离子水(对照组)相比,5-Fu-Si NSs组250 µg mL-1的温度从28.01迅速升高到5 分钟内达到 46.56 °C,照射 10 分钟后达到最高温度 50.10 °C(图 3c)。分别研究了不同浓度 5-Fu-Si NSs(25、50、100、250 和 500 µg mL-1)在 808 nm 激光照射(1.0 W cm-2)下的光热图像(图3d)。此外,我们还研究了在 808 nm 波长下激光照射 (1.0 W cm-2) 后 5-FuSi NSs (18.75 µg mL-1) 中 5-Fu 的释放。随着激光照射时间的增加,一些 5-Fu 从 5-Fu-Si NSs 中释放出来。接下来,还研究了在不同激光功率照射下 5-Fu-Si NSs 的温升效应浓度为 250 µg mL-1(图 3e)。这些发现表明 5-Fu-Si NSs 具有出色的 PTT 能力。其温升效应与激光功率呈正相关。随后,还研究了 5-FuSi NSs 的光热稳定性。如图 3f 所示,经过 5 次加热/冷却循环后,光热转换行为甚至没有变化。这些结果表明,5-Fu-Si NSs 在激光照射前后具有出色的光热稳定性。此外,计算出的光热转换效率可以达到45.8%,远高于先前报道的结果。[40,41] 这些结果表明 5-Fu-Si NSs 可以用作潜在的 PTT 剂。
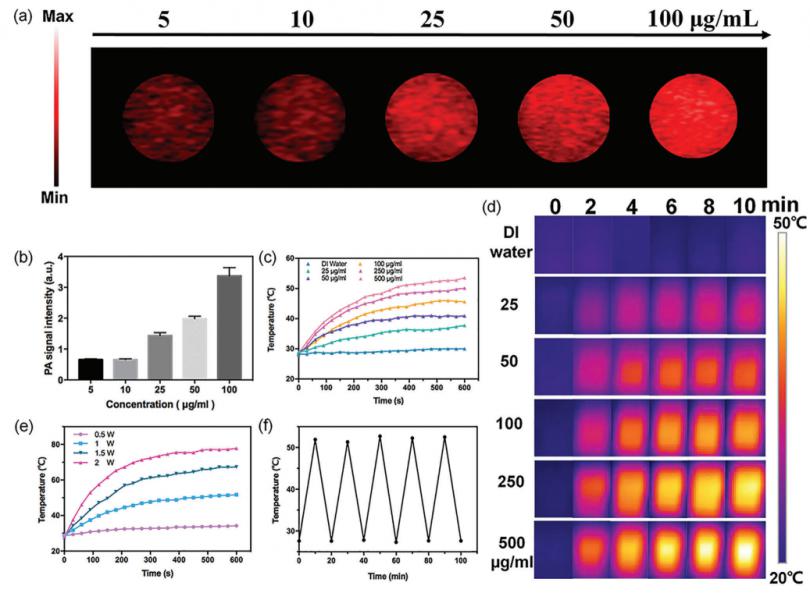
图3. a)不同浓度的5-Fu-Si NSs在808 nm处的体外PA信号。c)不同浓度(25、50、100、250、500µg/mL)的5-Fu-Si纳米ss在808 nm激光照射(1.0 W cm−2,10 min)下的光热效应。d)不同浓度(25、50、100、250、500µg mL−1)的5-Fu-Si纳米ss在808 nm激光(1.0 W cm−2,10 min)照射下的热像。e) 250µg mL−1的5-Fu-Si在不同激光能量下的光热效应。f) 5-Fu-Si NSs的循环光稳定性。
05-PA成像和光热效应的体内评估
在体外PA造影剂和PTT剂验证提示下,我们继续开展体内实验研究。如图 4a(顶行)和图 4b 所示,PA 信号是在给药前 0 小时获得的。 然后,静脉注射后肿瘤区域的PA信号显着逐渐增加。 分别在 2、5、8、12 和 24 小时将 Si NSs(50 mg kg-1)注射到 U87-MG 肿瘤模型中。 从图 4a 中三排的 5-Fu-Si NSs (50 mg kg-1) 也观察到相同的现象。如图 4b 所示,随着时间的延长,肿瘤区域的 PA 信号强度逐渐增加。5-Fu-Si NSs 和 Si NSs 的 PA 信号分别在注射 5 小时和 8 小时后达到峰值。值得注意的是,如图 4b 所示,注射 5 小时后,5-Fu-Si NSs 的 PA 信号强度高于 Si NSs。 并且,5-Fu-Si NSs 的峰值 PA 信号比将 5-Fu-Si NSs 注入相应肿瘤区域之前的初始 PA 信号大 3.6 倍(图 4b)。 此外,5 小时的 SaO2 峰值浓度比注入 5-Fu-Si NSs 前 SaO2 的初始浓度高 3.76 倍(图 4c)。 还评估了不同时间点的 HbT,表明它具有改善脱氧环境的能力(图 4d)这些结果充分证明了 Fu 修饰的 Si NSs 由于均匀分散和稳定性而更快地到达肿瘤部位,并且还表明 EPR 效应增强了渗透性和保留。 5-Fu-Si NSs 可以显着增强肿瘤切片中的 PA 信号强度,这是由于血管丰富,血管壁空间宽,结构完整性差,无淋巴回流。注射24小时后仍观察到肿瘤区域PA信号的增强,表明5-Fu-Si NSs在体内相对较长的循环时间可能与Fu分子的表面修饰有关。注射Si NSs和5-Fu-Si NSs后,还提供了不同时间点(0、5和24小时)肿瘤区域PA信号强度和SaO2的3D分布(图4e)。体外生物学分布表明,5-Fu-Si NSs 可以在 24 小时后在大多数组织中减少和清除(图 S5,支持信息)。在确认了 5-Fu-Si NSs 在体内肿瘤中的蓄积作用后,我们随后评估了 5-Fu-Si NSs 在体内的热化学治疗效果。带有 U87-MG 肿瘤的小鼠在静脉注射后暴露于 808 nm 激光(1.5 W cm-2)5 小时。通过红外热成像监测肿瘤区域的温度变化。 5-Fu-SiNSs组肿瘤区温度在5分钟内迅速升高12℃,显示出良好的PTT效果,而PBS对照组几乎没有升温效应。相反,由于麻醉下的生理原因,温度略有下降(图 4f,g)。总体而言,这些结果表明 5-Fu-Si NSs 是一种用于肿瘤诊断和治疗的有前途的生物相容性热化学治疗试剂。

图4. a)静脉注射Si NSs和5-Fu-Si NSs后不同时间点肿瘤体内PA显像。b)肿瘤不同时间点PA强度。c)不同时间点肿瘤SaO2强度。d)不同时间点肿瘤HbT信号强度。e) Si NSs和5-Fu-Si NSs不同时间点的肿瘤体内3D重建PA成像。f) 808 nm激光照射(1.5 W cm2)下不同组U87-MG荷瘤小鼠热像图。g)不同时间点肿瘤区域温度变化的定量分析。
06-OCTA/LS 成像对微血管变化的体内跟踪和评估
微血管是输送营养物质和清除组织中废物的Unique通道。特别是,它在肿瘤生长和转移中起着重要作用。 鉴于此,为了研究肿瘤早期生长和热化疗过程中的肿瘤血管生成和微血管形态学变化,我们对带有 U87-MG 神经胶质瘤的 BALB/c 裸鼠进行了背部皮肤窗口,用于长期 OCTA 和 LS 成像(图 5a)。 图 5b 显示了代表性的白光、OCTA 和 LS 图像(从左到右列),它们是从一个对照组 (PBS) 和两个实验组(5-Fu-Si NSs 和 5-Fu-Si NSs plus)收集的 激光)共 13 天。随着肿瘤的生长,在用PBS处理之前,对照组中肿瘤区域的微血管(用白色虚线标记)从中心到边缘逐渐缩小(图5c)。 并且,基于这种现象,肿瘤中心区域的 RBF 也降低了(图 5f)。肿瘤内血管塌陷可能是由于癌细胞在相对狭窄的空间内快速增殖所致。在第七天,PBS 溶液是 i.v.注射到荷瘤裸鼠体内作为对照组。之后,肿瘤ROI内的血管保持了较低的MVD和RBF的特征。另一方面,随着肿瘤组织的快速生长,肿瘤细胞会分泌大量的血管内皮生长因子,促使新生血管形成,为肿瘤细胞提供足够的氧气和营养,以供肿瘤细胞繁殖。]如 LS 图像所示。图 5b 中的对照组,随着肿瘤的生长,肿瘤周围的供血网络结构发生变化,原有血管的新生血管形成,其中 LS 图像中的血管被颜色编码以表示来自红色的 RBF(较高) 到蓝色(下)。此外,与肿瘤生长早期(0-3天)相比,生长后期(9-13天)肿瘤区域周围的RBF相对增加,以维持肿瘤细胞的生长。对于用 5-Fu-Si NSs 治疗的实验组,在实体瘤中心,我们还观察到与对照组相似的微血管变化,包括较低的 MVD 和 RBF(图 5d,g),在静脉注射之前。注入 5-Fu-Si NSs。 随后,静脉注射后注射 5-Fu-Si NSs(7-13 天),在肿瘤的 ROI 中,我们观察到几个新血管,MVD 和 RBF 略有增加(图 5d,g)。 这些结果表明,作为单一化疗方法,5-Fu-Si NSs在一定程度上抑制了肿瘤细胞的快速生长,相对减轻了实体瘤内的组织压力,使肿瘤内的血管得以恢复。 . 此外,被肿瘤破坏的微血管网络没有完全恢复,肿瘤周围的RBF相对高于肿瘤早期,这意味着我们实验过程中5-Fu-Si NSs并未完全清除肿瘤细胞。此外,我们监测和评估了在热化疗策略(静脉注射 5-Fu-Si NSs 加激光照射)下动物肿瘤模型的微血管变化。从图5b中可以看出,在热化疗治疗之前,实体瘤中心的原始血管结构被破坏,导致ROI的RBF明显下降(图5h)。 此外,肿瘤区域内的外围含有致密的新血管(图 5b),这导致 MVD 略有增加(图 5e)。 热化疗后,肿瘤组织和受累血管均被清除。 更重要的是,肿瘤区域周围的血管逐渐恢复,为修复受损组织提供氧气和营养(9-13天)。
由此可知,OCTA/LS 成像技术能够精确跟踪和评估肿瘤生长过程中和治疗后的体内微血管变化,可以成为为医生提供有价值的肿瘤诊断和治疗效果信息的有力工具。
图5. a) 5-Fu-Si NSs小鼠模型、治疗及监测方案示意图。b)各组不同时间点有代表性的白光、OCTA、LS图像。白色虚线代表肿瘤区域和ROI区域。c) PBS处理定量血管总密度。d) Si NSs处理量化总血管密度。e) 5-Fu-Si NSs加激光照射定量血管总密度。f) PBS治疗RBF定量。g)用Si NSs处理定量RBF。h) 5-Fu-Si NSs加激光照射定量RBF。标尺:2毫米。
07-体内药代动力学
由于表面氟尿嘧啶修饰提高了生物相容性,5-Fu-Si NSs 可能比 Si NSs 具有更长的循环寿命。为了进一步验证这一点,通过静脉注射探索了体内药代动力学。 向 SD 大鼠注射 Si NSs 和 5-Fu-Si NSs。如图 6g 所示,在 SD 大鼠中,5-Fu-Si NSs 的血浆浓度随时间衰减比 Si NSs 慢得多。这些结果进一步证实了5-Fu-Si NSs在血液中的循环寿命更长,并且比Si NSs具有更好的药物特性,这将有利于增强5-Fu-Si NSs在肿瘤部位的富集和渗透性。
08-热化学疗法的体内抗肿瘤活性
上述研究证实了 5-Fu-Si NSs 的体外治疗效果,进一步证明 5-Fu-Si NSs 优越的蓄积性和渗透性可以实现体内增强的抗肿瘤活性和协同热化疗,U87-MG 肿瘤将荷瘤裸鼠随机分为以下六组:1) PBS, 2) PBS 加激光, 3) Si NSs, 4) Si NSs 加激光, 5) 5-Fu-Si NSs, 6) 5-Fu -Si NSs 加激光。如图6a-d所示,5-Fu-Si NSs对肿瘤生长有抑制作用,但作用不显着。与此形成鲜明对比的是,5-Fu-Si NSs加激光对肿瘤生长具有更高的抑制作用。 Si NSs加激光组虽然有抑制作用,但由于缺乏化疗药物清除残留肿瘤组织,消融一段时间后出现二次生长。值得注意的是,在治疗期间,5-Fu-Si NSs荷瘤裸鼠的体重没有显着变化(图6e),并且在连续随访期间没有发现荷瘤裸鼠死亡在该组中(图 6f)。
接下来,为了验证这些 NTAs 的体内生物安全性,还通过苏木精和伊红 (H&E) 染色评估了上述涉及心脏、肝脏、pizang、肺和肾脏的主要器官的病理生物学。如图S6,支持信息所示,用5-Fu-Si NSs处理的荷瘤裸鼠的主要器官未显示明显异常,这清楚地表明5-Fu-Si NSs在体内是安全的。此外,肿瘤切片的H&E染色显示肿瘤结构受损,治疗组癌细胞密度显着降低。细胞核缩小,肿瘤细胞被破坏(图 6h)。所有这些结果表明,5- Fu-Si NSs 可以作为潜在的 PA 显像剂,通过结合化疗和 PTT 的优势实现有效的 PA 引导的癌症治疗,以及实现长期高分辨率的肿瘤监测在显微 OCTA 和 LS 成像策略下。因此,具有生物相容性的5-Fu-Si NSs有望作为光子诱导治疗药物用于肿瘤的诊断和治疗。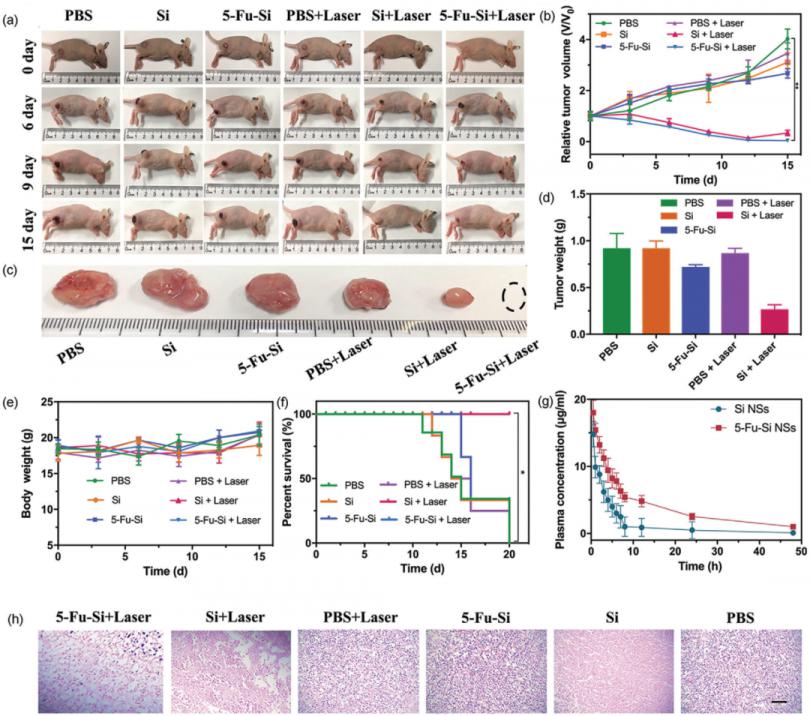
图6. a)各种治疗U87-MG荷瘤小鼠的代表性照片。b)各组相对肿瘤体积(*P < 0.05, **P < 0.01)。c)结束时不同组小鼠肿瘤的代表性照片。d)切除肿瘤重量。e)各组荷瘤小鼠体重。f)不同配方处理的成活率。g) Si和5-Fu-Si NSs在SD大鼠体内的药代动力学谱。h)终点小鼠肿瘤组织的H&E染色。标尺:100µm。
小结
通过弱相互作用力开发的新型多模态光学对比纳米平台能够实现按需药物释放和体内协同热化学疗法。受益于材料的二维物理特性,释放的药物表现出优异的体外抗肿瘤活性。 更有趣的是,系统和体内研究表明,由于增强的肿瘤富集和有效的药物递送,5-Fu-SiNSs不仅具有光声成像的效果,而且可以在引导下实现对肿瘤的长期显微监测。 光声,在光诱导下也能实现良好的肿瘤消融。 因此,5-Fu-Si NSs 是一种很有前途的近红外光子试剂,具有出色的治疗效果和生物安全性,可用于临床转化。
参考文献:Doudou Huang, et al. "Intravital Whole-Process Monitoring Thermo-ChemotherapyVia 2DSilicon Nanoplatform: A Macro Guidance andLong-Term Microscopic Precise ImagingStrategy." ADVANCED SICENCE, ,2101242(2021).2022-06-02相关仪器 -
免责声明
①本网刊载上述内容,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任
②若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi

-
 仪网通铜牌会员 第
2 年
仪网通铜牌会员 第
2 年北京心联光电科技有限公司
认证:工商信息已核实
- 产品分类
- 品牌分类
-
仪企号
 北京心联光电科技有限公司
北京心联光电科技有限公司
-
友情链接
-
手机版开启全新的世界m.yiqi.com/zt70569/








