-
 离子 离子键简介
离子 离子键简介
 离子 离子键简介
离子 离子键简介
带相反电荷的离子之间存在静电作用,当两个带相反电荷的离子靠近时, 表现为相互吸引,而电子和电子、原子核与原子核之间又存在着静电排斥作用,当静电吸引与静电排斥作用达到平衡时,便形成离子键。因此,离子键是指阴离子,阳离子间通过静电作用形成的化学键。
一、离子键基本性质
1、离子键定义:阴、阳离子结合成化合物的静电作用
2、离子键成键微粒:阴、阳离子
阳离子:IA、IIA活泼金属元素,NH4+;
阴离子:VIA、VIIA活泼非金属元素,OH-、SO42-、NO3-、CO32-等。
注意:形成化合物的元素的电负性的差>1.7
3、离子键成键性质与特点:
性质:静电作用(吸引与排斥)
特点:没有方向性,没有饱和性
注意:阳离子与阴离子半径比值越大,离子周围所能容纳带异性电荷离子的数目就越多。
4、离子键存在范围:
大多数盐(如NaCl、CsCl、NH4Cl等)
强碱(如NaOH、KOH等)
活泼金属氧化物(如MgO、Na2O等)
5、离子键强弱的判断:
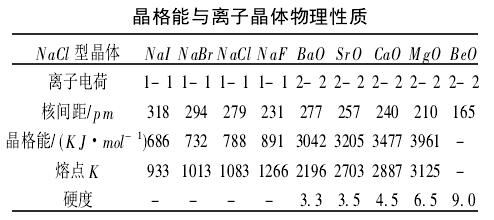
离子半径越小,离子所带电荷越多,离子键越强,离子晶体的熔沸点越高。离子键的强弱也可以用晶格能的大小来衡量,晶格能是指拆开1mol离子晶体使之形成气态阴离子和阳离子所吸收的能量。晶格能越大,离子晶体的熔点越高、硬度越大。
6、离子晶体:通过离子键作用形成的晶体。
7、典型的离子晶体结构:
NaCl型和CsCl型。氯化钠晶体中,每个钠离子周围有6个氯离子,每个氯离子周围有6个钠离子,每个氯化钠晶胞中含有4个钠离子和4个氯离子;氯化铯晶体中,每个铯离子周围有8个氯离子,每个氯离子周围有8个铯离子,每个氯化铯晶胞中含有1个铯离子和1个氯离子。
二、离子键的形成
离子键是由电子转移(失去电子者为阳离子,获得电子者为阴离子)形成的。带相反电荷的离子之间存在静电作用,当两个带相反电荷的离子靠近时,表现为相互吸引,而电子和电子、原子核与原子核之间又存在着静电排斥作用,当静电吸引与静电排斥作用达到平衡时,便形成离子键,即正离子和负离子之间由于静电引力所形成的化学键。
离子既可以是单离子,如Na+、Cl-;也可以由原子团形成;如SO42-,NO3-等。它往往在金属与非金属间形成。失去电子的往往是金属元素的原子,而获得电子的往往是非金属元素的原子。通常,活泼金属与活泼非金属形成离子键,如钾、钠、钙等金属和氯、溴等非金属化合时,都能形成离子键。且仅当总体的能级下降的时候,反应才会发生(由化学键联接的原子较自由原子有着较低的能级)。下降越多,形成的键越强。
而在现实中,原子间并不形成“纯”离子键。所有的键都或多或少带有共价键的成分。成键原子之间电平均程度越高,离子键成分越低。
离子键的结合力很大,因此离子晶体的硬度高,强度大,热膨胀系数小,但脆性大。离子键种很难产生可以自由运动的电子,所以离子晶体都是良好的绝缘体。在离子键结合中,由于离子的外层电子比较牢固的被束缚,可见光的能量一般不足以使其受激发,因而不吸收可见光,所以典型的离子晶体是无色透明的。Al2O3、MgO、TiO2、NaCl等化合物都是离子键。
当元素周期表中相隔较远的正电性元素原子和负电性元素原子接触时,前者失去Z外层价电子变成带正电荷的正离子,后者获得电子变成带负电荷的满壳层负离子。正离子和负离子由静电引力相互吸引;同时当它们十分接近时发生排斥,引力和斥力相等即形成稳定的离子键。
三、离子键的强弱——晶格能
离子晶体中晶格的牢固程度可用晶格能(U)的大小来衡量。晶格能愈大,其离子键愈牢固,离子晶体愈稳定。晶格能是在298.15K、101.325KPa下由气态正离子和气态负离子生成1mol离子晶体时所放出的能量。
玻恩和哈伯提出可应用一些已知的热力学实验数据计算出离子晶体的晶格能,这种方法就是“玻恩——哈伯循环法”。现以某种离子卤化物MXn为例说明其计算方法。
1、ΔH1θ是MXn的标准焓变。
2、ΔH2θ是1molM(s)变为1molM(g)的标准焓变(即升华焓)。
3、ΔH3θ是氯分子的离解焓变。
4、E是氯离子的电子亲合能。
5、I是M的电离能。
6、U是MXn的晶格能。
根据盖斯定律,可计算出上述循环中MXn晶体的晶格能(U)。
ΔH1θ=ΔH2θ+ΔH3θ+E+I+U
由上式推知:U=ΔH1θ-ΔH2θ-ΔH3θ-E-I
利用已知的ΔHθ,I,E就可求出晶格能U
用晶格能大小比较卤化物的稳定性:
1、NaCl
查数据手册知:
1、NaCl的标准生成焓变ΔH1θ=-411.0KJ·mol-1。
2、1mol金属钠升华变成1mol气态钠原子标准焓变(即升华焓)ΔH2θ=108.7KJ·mol-1。
3、氯分子离解成1mol氯原子焓变ΔH3θ=121.3KJ·mol-1。
4、钠原子的电离能I=495.8KJ·mol-1。
5、氯离子的电子亲合能E=-348.7KJ·mol-1。
将以上数据代入前边推出的计算式中:
U=ΔH1θ-ΔH2θ-ΔH3θ-E-I=-788.1(KJ·mol-1)
即由Na(g)+和Cl(g)-生成1molNaCl晶体时,要释放出788KJ能量。
2、KCl
查数据手册知:
1、KCl的标准生成焓变ΔH1θ=-436.2KJ·mol-1。
2、1mol金属钾升华变成1mol气态钾原子标准焓变(升华焓)ΔH2θ=81.6KJ·mol-1。
3、氯分子离解成1mol氯原子焓变ΔH3θ=121.3KJ·mol-1。
4、钾原子的电离能I=418.8KJ·mol-1。
5、氯离子的电子亲合能E=-348.7KJ·mol-1。
将上述数据代入前边的计算式中:
U=ΔH1θ-ΔH2θ-ΔH3θ-E-I=-709.2(KJ·mol-1)
即由K(g)+和Cl(g)-生成1molKCl晶体时,要释放出709.2KJ能量。
据已计算出的数据比较:
因为UKCl(s)=-709.2(KJ·mol-1)>UNaCl(s)=-788.1(KJ·mol-1)所以NaCl比KCl稳定。
晶格能不仅可以用来判断离子晶体的稳定性,还可以反映在离子晶体的物理性质上。
在晶形相同的离子晶体中,若离子电荷愈多,半径愈小,则晶格能愈大。离子晶体的晶格能愈大,表明晶格结点上的离子间结合愈牢固,反映在晶体的物理性质上,将具有较高的熔点、沸点和硬度。
下表列出了一些物质的晶格与物理性质之间的关系:
四、共价键和离子键
共价键和离子键的概念:
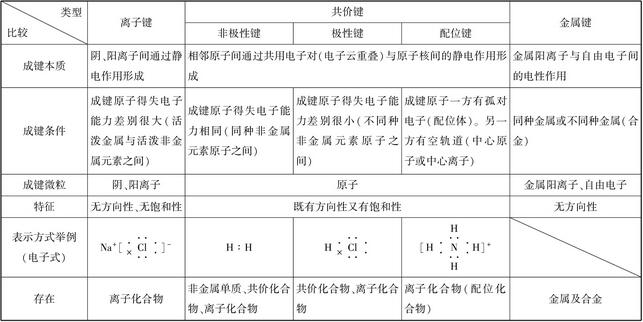
共价键和离子键是对化学键的两种分类。
共价键是指两个原子之间的电子,它们的自旋方向不同,甚至是相反的两个方向的电子在配对后,原子的轨道叠合在一起时,电子的云密度在增大的时候,同时增大对两核的引力。而共价键的作用力很大,具有方向性,而又因为电子方向相反的电子能够配成键,所以共价键也具有饱和性。共价键又可以根据其方向性和饱和性分成三种,分别是非极性共价键、极性共价键以及配价键。
离子键是因为在电子发生转移的情况下形成的,也就是说,离子键是正负离子在静电引力的作用下而形成的化学键,其实质是静电作用。它的成键离子有阴、阳离子这两类,所以离子键可以分成两类,一种是阳性钠离子和阳性钾离子这样的单离子,另一种就是阴性的氯离子这类由原子团组成的带有化学键的物质。
共价键和离子键的不同点:
共价键和离子键的区别主要表现在:
①它们的概念不一样,共价键是一种只含有共价键的化合物,而离子键是含有离子键的化合物。它们的实质也不一样,前者是共用原子对,后者是静电作用。
②前者对物质的影响和后者也不相同,共价键表现出来的是,当共价键越强,那么其单质或者化合物就越稳定。而离子键越强,其熔点也越高。
③在导电性上,共价键在融化时不导电,其水溶液部分会导电。而离子键的熔融状态或者其水溶液是导电的。
④共价键和离子键的不同点还包括,它们在融化时的破坏力不同。共价键在融化时破坏的作用力一般是不会破坏共价键的,而离子键在融化时破坏的作用力,一般是破坏离子键,在部分情况下才可能破坏共价键。
共价键和离子键的相同点:
共价键和离子键的共同点,主要表现在它们都是相邻的两个或多个原子在强烈的相互作用下,形成的化学键。并且,也都是在电性作用下形成。
①本文由仪器网入驻的作者或注册的会员撰写并发布,观点仅代表作者本人,不代表仪器网立场。若内容侵犯到您的合法权益,请及时告诉,我们立即通知作者,并马上删除。
②凡本网注明"来源:仪器网"的所有作品,版权均属于仪器网,转载时须经本网同意,并请注明仪器网(www.yiqi.com)。
③本网转载并注明来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
④若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi