生物药工艺过程相关杂质的检测
生物药物包括单抗、重组蛋白、病毒载体等,通常都是通过细胞表达产生,经过纯化、除 菌过滤、制剂工艺后获得。在工艺过程中会产生包括微生物污染、热原、细胞成份、培养基中的成份等外来杂质,这些杂质会影响最 终药品的安全性和有效性,在开发过程中对杂质的鉴别、定量、定性和控制是非常重要的。

1)内毒素
内毒素是革兰氏阴性细菌细胞壁中的一种成份,叫做脂多糖,由细菌死亡自溶时释出,又称之为“热原”,进入人体内会引起急性炎症反应。
目前对于内毒素的检测主要分为:基于传统的鲎采血的LAL/TAL法,和出于对鲎资源的保护而新起的基于重组 C 因子的内毒素检测方法。LAL/TAL法是从栖生于海洋的节肢动物“鲎”的蓝色血液中提取变形细胞溶解物制作而成,LAL试剂来自于美洲鲎,TAL试剂来自于东方鲎。LAL/TAL法一般通过多个酶促级联凝固,以凝胶法、比浊法或显色法定量。LAL/TAL法简单﹑快速﹑灵敏﹑准确,因而被欧美药典及我国药典定为法定内毒素检查法,并已被世界各国所采用。
重组C因子法是利用重组技术合成的内毒素特异性酶,被活化后可直接与荧光底物作用产生与内毒素浓度成比例的荧光信号,从而实现定量。由于内毒素检测的需求持续上升,而鲎资源却在急剧紧缩,因此重组C因子法目前已被世界主流药典认同。
丹纳赫生命科学旗下美谷分子的多功能酶标仪可用于LAL法和重组 C 因子法的多种内毒素试剂盒检测。
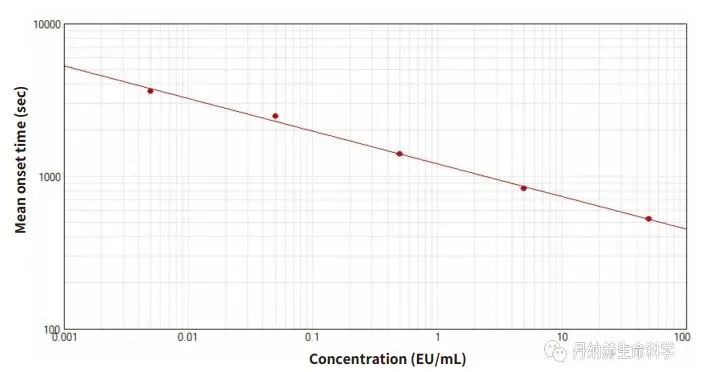
SpectraMax i3x上的动态显色LAL 实验
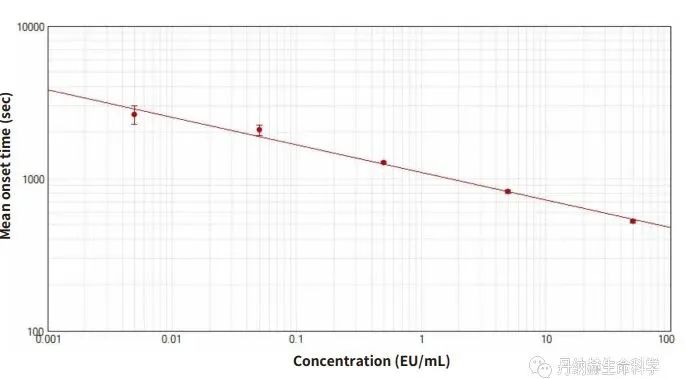
SpectraMax M5e上的动态显色 LAL 实验

MD的SpectraMax i3x多功能酶标仪

MD的SpectraMax M5e多功能酶标仪
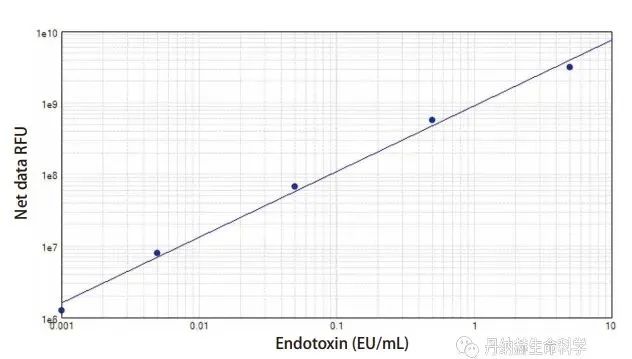
采用PyroGene 重组因子C试剂盒进行内毒素检测
特别是SpectraMax i3x多功能酶标仪具有光吸收、荧光、化学发光和FRET检测功能,兼容客户端模块化升级功能,可以根据需要,任何时间随意升级至荧光偏振FP、HTRF、AlphaScreen、Western Blot、细胞成像和带有注射器模式下的快速动力学检测等,还可进行ELISA宿主细胞残留蛋白、牛源污染物(如:BSA、IgG、胰岛素、铁传递蛋白)、蛋白A和G等杂质的检测。
2)宿主细胞残留DNA
宿主细胞残留DNA(HCD)是一种可能存在于终产品中的工艺相关杂质,存在制瘤性和感染性的风险。现有研究表明,可能引发致病的功能基因至少在200 bp以上,因此残留DNA片段越大,风险等级越高。美国食品药品监督管理局(FDA)关于人类基因治 疗新产品生产指导文件中明确指出HCD的片段要小于200 bp;国家药品监督管理局(NMPA)生物制品药学部同样在《基因治 疗产品药学研究与评价技术指导原则》的征求意见稿中指出,HCD的片段要小于200 bp。因此基因治 疗终产品中需要合适的方法检测HCD的片段大小分布情况。
SCIEX的毛细管电泳PA 800 Plus制药分析系统采用凝胶电泳激光诱导荧光的检测方式,可对宿主细胞残留DNA的片段进行高灵敏的检测。使用SCIEX eCAP™ dsDNA 1000 试剂盒可分离50-1000 bp范围的DNA片段,定量限低至10 pg/mL。若在前处理的过程中对DNA进行浓缩处理,可获得更高的检测灵敏度,满足各种残留DNA片段分布检测的需求。
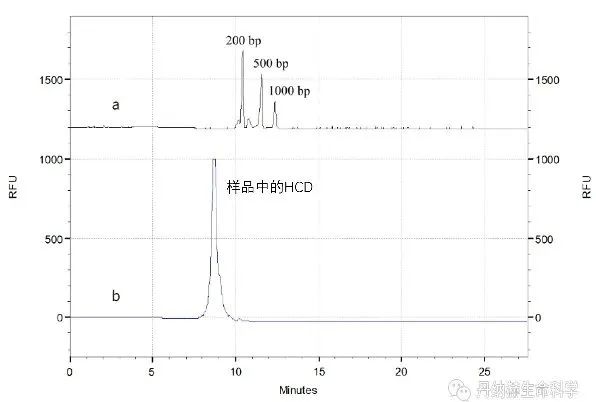

3)不溶性微粒
注射剂药物在生产、运输或使用过程中,因为各种原因造成空气颗粒污染及玻璃瓶掉渣,甚至因为稳定性差导致药物颗粒发生团聚析出。有大量的研究报道,不溶性微粒注射到人体后会产生各种危害,包括:血管栓塞、静脉炎、免疫原性反应等,为此各国药典都对注射液中不溶性微粒的检测做了严格的规定,包括美国USP788和USP787,中国CP0903,欧洲EP 2.9.19,以及日本JP和韩国KP,都对其中10µm和25µm以上的颗粒数做了严格的限制。
需要特别指出的是,眼科溶液的不溶性微粒检查在USP789中更加严格,不仅对大于10µm和25µm的颗粒数有更低限制的规定,而且还对大于50µm的颗粒数有要求。
目前中国药典推荐采用光阻法及显微计数法对不溶性微粒进行检测。贝克曼库尔特 HIAC 9703+不溶性微粒检测仪,采用光阻法原理,满足多国药典对各类注射剂药物的测试要求,同时根据USP787和CP0903小体积测试规定,对于珍贵样品单次检测体积只需200μL,即单个样品体积不到1.5mL即可完成不溶性微粒的检测,在大大节省测试样本的同时保证了制剂的高质量品质。

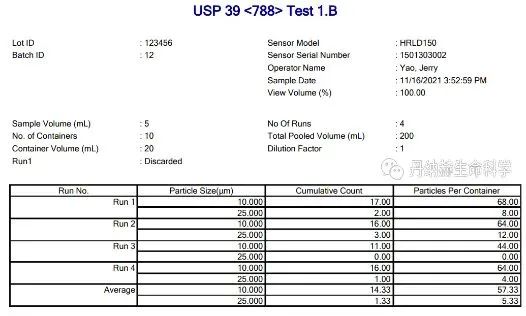
贝克曼库尔特 HIAC 9703+ 不溶性微粒检测仪
随着制剂技术的快速发展,产生了很多新型制剂,如注射用乳剂、混悬剂等,这类样品的特殊性,不适合用光阻法进行不溶性微粒检测,可采用显微计数法进行检测。徕卡显微系统的DM4P 偏光显微镜使用透射正交偏光进行不溶性颗粒观察,药物颗粒呈亮白色,载玻片呈黑色,色差明显,可以消除分析过程中载玻片颜色对微粒识别的干扰。配合专业的清洁度检测解决方案:scanning stage + LAS X navigator 可以快速自动检测出一定尺寸范围内的颗粒的数量。


徕卡DM4P 偏光显微镜
生物药物工艺流程的复杂性导致了工艺过程杂质的多样性,不同分析方法的应用推动了工艺流程的优化和药物使用的安全,同时临床上药物的不良反应,又对引起这些不良反应的相关杂质的深入研究起到了推动作用。丹纳赫生命科学的多方位杂质检测方案可以更加深入助力生物药物工艺过程的改善。
全部评论(0条)
推荐阅读
-

- 生物药工艺过程相关杂质的检测
- 杂质会影响最 终药品的安全性和有效性,在开发过程中对杂质的鉴别、定量、定性和控制是非常重要的。
-

- 生物药工艺过程相关杂质的检测
- SCIEX的毛细管电泳PA 800 Plus制药分析系统采用凝胶电泳激光诱导荧光的检测方式,可对宿主细胞残留DNA的片段进行高灵敏的检测。
-
- 讲座预告 | 生物药工艺革新:上游工艺创新与过程分析
- 讲座预告 | 生物药工艺革新:上游工艺创新与过程分析
-
- 会议邀请 | 生物药工艺开发与优化
- 会议邀请 | 生物药工艺开发与优化
-

- 2023BPD第六届生物药工艺峰会本周开启!
- 2023 BPD 第六届生物药工艺发展峰会 将于本周 8月3-5日 在 上海张江科学会堂 盛大召开。
-
- 【国际网络研讨会】MALS技术助力mRNA药物CQA、工艺及相关杂质分析
- 云端相聚! 共同探讨强制降解体外转录mRNA的综合色谱分析
-
- 生物上游过程工艺开发阶段通过拉曼光谱提高对mAb生产的可靠性
- 拉曼技术在生物工艺开发中的应用已经显示出其在培养工艺和过程监测的巨大潜力。但在生物工艺开发过程中,当克隆、培养基或培养规模等条件发生变化时,拉曼技术的性能仍面临一些挑战和限制。本研究提出了一种实用的P
-
- 哈希邀您共赴2024BPD 第七届生物药工艺发展大会
- 哈希邀您共赴2024BPD 第七届生物药工艺发展大会
-

- 瑞沃德精彩亮相2023BPD第六届生物药工艺发展峰会
- 2023年8月4日-5日,为期两天的2023BPD第六届生物药工艺发展峰会在上海张江顺利举行!
-

- 四川生物药配方检测及成分化验
- 生物药成分分析,生物药配方化验,生物药成分鉴定等找不到能做的机构或公司?
-
- 困难的事交给专业的人 | Cytiva参展2024 BPD第七届生物药工艺发展大会
- 2024年8月9-10日,上海张江科学会堂,T037 Cytiva展位诚邀您来。
-

- 全国生物过程标准化工作小组获批成立 对相关仪器的评价结果有哪些作用?
- 工作小组的成立旨在制定和完善生物过程的标准化流程,其中对相关仪器的评价结果是其工作的重要组成部分。仪器评价结果作为衡量设备性能的关键指标,对于保障实验数据的准确性和可重复性至关重要。
-

- 药食同源食品试点进展浅析及相关检测初探
- 而污染物及有害因素风险监测又会有较大差异,如甘肃的党参、黄芪、肉苁蓉检测项目,包括重金属、农残、生物毒素和二氧化硫。
-
- 默克Milli-Q邀您参加【2024 BPD第七届生物药工艺发展大会】
- 默克Milli-Q?邀您参加【2024 BPD第七届生物药工艺发展大会】
①本文由仪器网入驻的作者或注册的会员撰写并发布,观点仅代表作者本人,不代表仪器网立场。若内容侵犯到您的合法权益,请及时告诉,我们立即通知作者,并马上删除。
②凡本网注明"来源:仪器网"的所有作品,版权均属于仪器网,转载时须经本网同意,并请注明仪器网(www.yiqi.com)。
③本网转载并注明来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
④若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi
























参与评论
登录后参与评论