【重要】合规软件只有审计追踪和电子签名还远远不够
自 2003 年美国食品与药品管理局出台了联邦法规第 21 章第 11 款(FDA 21 CFR Part 11),对电子数据的真实性、完整性和可靠性,以及电子签名有效性,收集和分析数据的软件必须是经过验证的S次提出了要求。

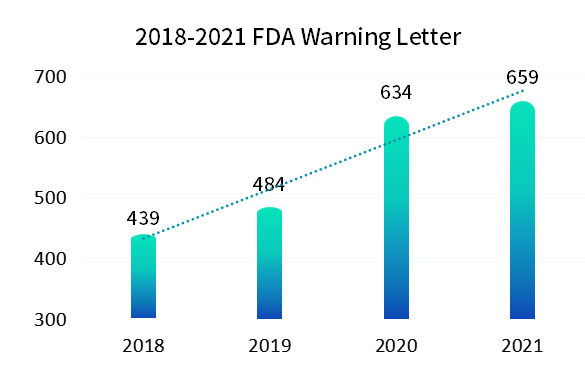
与纸质记录相比,电子记录是动态记录必然会暴露出更多的不合规操作, 2015 年警告信 FDA 483 表格和现场观察报告频频出现,全 球各地监管机构再次更新和完善了一轮法规要求。新法规施行后(2018 版 FDA 21CFR Part11),我们看到如下图统计,Z 近几年 FDA 发出的警告信也呈现出逐年上升趋势。作为合规软件的供应厂商,我们也明显感受到国内客户对于合规的要求也是越来越高。
每年年底/年初,制药公司、生物技术公司、CRO、CDMO 等都会进行合规的企业内部审计或国家审计局委派当地审计局进行审计。今年接到多次电话咨询,无论内审还是外审都提到了操作员登录软件是否会被记录到审计追踪中。从审计关注点我们可以看出,国内对审计追踪记录完整性要求在提高,审计追踪不仅仅记录修改,还要记录登录/登出和查看信息;这也从侧面反映法规对数据的隐私性越来越重视了。
Molecular Devices 公司 SoftMax Pro 7.1.2 GxP 软件除了能够记录完整的审计追踪,还能够记录数据文件的生命周期,实现对数据来源和去向的全流程管理,真正做到无纸化、全流程电子记录和电子签名,Z 大限度保证数据记录的真实性、完整性和可靠性。
为什么 我们要对数据进行全流程管理?
因为 2020 年 12 月 1 日正式施行的国家药品监督管理局发布的药品记录与数据管理要求(试行)第二章基本要求中有如下要求,

针对这项Z 新要求 SoftMax Pro 7.1.2 GxP 软件新增了数据文件状态显示(如下图),在数据库中和打开数据时都会显示当前文件所处的生命周期状态。

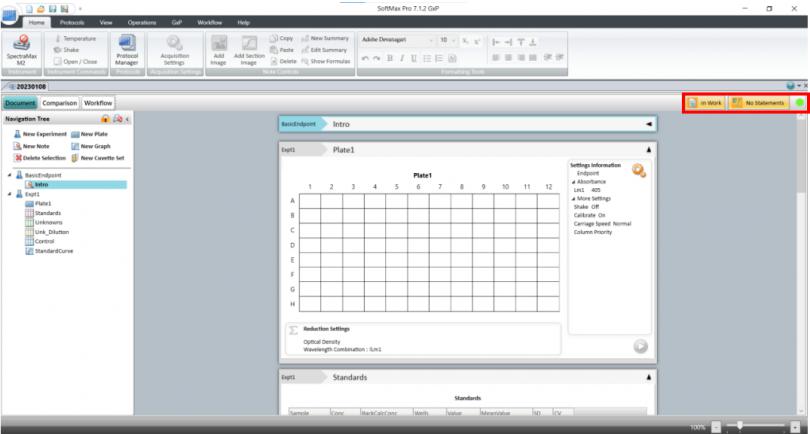
如 Scientist 权限新建数据状态是 in work 表示正在进行模板方法开发,经过 Lab Manager 层层审批并电子签名后可以更改文件状态并将开发好的模板 release 出来,这时 Lab Technician 才有权限打开模板进行读板和数据分析,签名后数据将被锁定不可更改,Lab Manager 审核后电子签名 Approved。如果发现数据有问题,可以 canceled;如果因为改进流程更新方法模板,可以将更改旧模板状态成 outdated,并不赋予 Lab Technician 打开 outdated 权限,以免使用错误模板读板产生不合规的数据。
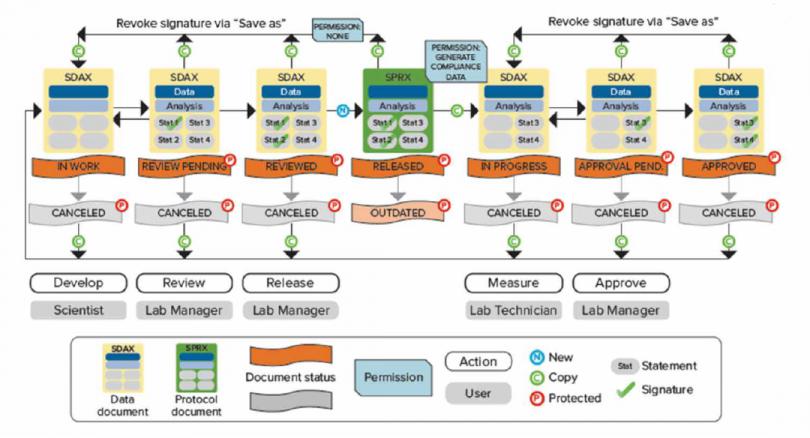
数据文件存储在 SQL Server 数据库中,文件的导入、重命名、移动、删除、归档等都会记录在审计追踪中,真正做到了从数据来源到Z 终归档全流程管控。
全部评论(0条)
推荐阅读
-

- 来了,带完整审计追踪功能的流式新软件!
- NovoExpress 是用于控制 NovoCyte 系列流式细胞仪进行采集、显示以及分析实验数据的工具,其软件设计以工作流程为导向,界面简洁清晰,功能直观明确,可即学即用
-

- 秒懂系列 | LabX管理下的审计应对和审计追踪
- 让我们来看一下这些缺陷或者漏洞是如何发生的,LabX的数据管理解决方案又是如何来解决这个问题的:
-
- 何谓电子签名?怎样才有效?
- 何谓电子签名?怎样才有效?
-

- 探索 Masshunter 12 软件套件效率与合规的双重保障
- 数据采集软件可对整个系统进行直观设置与操作,凭借直观的设计和易于使用的仪器特定功能。
-
- 【操作指引】如何查看BACT/ALERT 3D DUAL-T审计追踪信息
- 摘 要BACT/ALERT 3D DUAL-T是一款全自动化、基于微生物生长CO2呼吸作用、具有双温度培养控。
-
- Master the Flow | 安全感源自合规
- 安全感源自合规
-
- GMP合规--验证技术创新实践大会
- 上海溱孚科技有限公司诚邀您的莅临,7月11-12日与您相约:\x0d\x0a展位号: 2\x0d\x0a地 点:武汉光谷生物创新园会议中心
-

- 有奖调研 | 你,真的合规吗?
- 选用生物安全柜作为维持A级环境进行生产时,需注意以下几点:
①本文由仪器网入驻的作者或注册的会员撰写并发布,观点仅代表作者本人,不代表仪器网立场。若内容侵犯到您的合法权益,请及时告诉,我们立即通知作者,并马上删除。
②凡本网注明"来源:仪器网"的所有作品,版权均属于仪器网,转载时须经本网同意,并请注明仪器网(www.yiqi.com)。
③本网转载并注明来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
④若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi






























参与评论
登录后参与评论