研究背景
Vipp1是一种与ESCRT-III蛋白家族类似的细菌蛋白,广泛存在于细菌、古菌和真核生物中。ESCRT-III家族成员在细胞分裂、病毒复制、膜泡形成等多种生物学过程中发挥关键作用。在细菌中,Vipp1参与膜应激反应和修复,在蓝藻、藻类和植物中,Vipp1对于类囊体膜的生物发生和修复至关重要。Vipp1通过其核心折叠结构组装成丝状物,这些丝状物可以进一步形成平面片层、螺旋和环状结构,这些结构在膜重塑过程中起着关键作用。尽管已知Vipp1可以形成多种聚合形态,但其具体的组装机制和这些形态之间的几何关系尚不清楚。特别是,Vipp1如何在膜上感应并响应曲率变化,以及这些聚合物如何促进膜的稳定和修复,仍需进一步探究。此外,Vipp1的C末端结构域(CTD)如何调节其聚合动力学,以及这种调节如何影响膜重塑过程,也是当前研究的热点问题。
2024年11月,伦敦帝国理工学院Harry Low团队在《Nature Structural & Molecular Biology》发表了研究成果 “Mechanism for Vipp1 spiral formation, ring biogenesis, and membrane repair”, 作者通过多种实验方法,如荧光显微镜、高速原子力显微镜(F-AFM)和冷冻电镜(Cryo-EM)等,深入探究Vipp1在膜上的组装动力学、结构特点及其在膜修复中的作用机制。研究发现Vipp1是一种膜曲率传感器,能够在膜上组装成动态的螺旋、环和片层网络,同时揭示了Vipp1螺旋丝、平面片层和环之间的紧密结构关系,为Vipp1环的生物发生和膜稳定修复机制提供了分子模型,对理解其他ESCRT-III系统具有重要的参考价值。
为探究Vipp1与膜的相互作用特性,明确其是否对特定膜结构具有偏好性以及相互作用的动态过程。作者在低盐(10 mM NaCl)和高盐(500 mM NaCl)缓冲液中纯化来自Nostoc punctiforme的Vipp1,并借助共聚焦显微镜观察标记的Vipp1(Vipp1Alexa448)在支持脂质双层(SLBs)上的动态变化情况。在低盐缓冲液中,Vipp1形成多种三维聚合物;高盐缓冲液会促进其部分解聚。Vipp1Alexa448优先在SLB边缘形成局部涂层,且这种结合不受离子强度的影响。当相邻SLB融合时,结合的Vipp1会迅速从融合点解离。结果证实Vipp1是一种膜曲率传感器,对高度弯曲和扰动的膜具有强烈偏好,且与膜边缘的相互作用高度动态。
图1:Vipp1是招募到高度弯曲和扰动膜上的膜传感器。图a显示了Vippi在不同盐浓度下的结构变化,左图是低盐(10 mM NaCl)缓冲液中的Vippi,右图是500 mM NaCl缓冲液中的Vippi,可以看到Vippi的螺旋状丝带结构在高盐浓度下展开。图b是支撑脂质双层(SLBs)的制备过程。图c显示Vipp1Alexa448被招募到高度弯曲的膜边缘,且不受离子强度影响。图d是Vipp1Alexa448招募到膜边缘的动态时间曲线,显示Vipp1Alexa448逐渐被招募到膜边缘。图e显示相邻SLBs融合时,Vipp1Alexa448从膜融合点丢失。
作者利用F-AFM高时空分辨率的技术,进一步深入解析Vipp1在膜边缘的动态组装过程和形成的结构特征。 结果发现Vipp1在SLB边缘积累,形成动态的平面丝,这些丝会卷曲形成螺旋或环,最终覆盖整个脂质表面。研究人员还对丝的生长速度、宽度、螺旋直径和面积等进行了量化分析,发现螺旋会向内卷曲形成环,环最终会从母螺旋上脱落。此外,环也会在没有母螺旋的情况下自发形成。Vipp1在膜上能够组装形成动态的平面细丝、螺旋、环和片层网络,且这些结构之间存在动态的转化关系。
图2:Vipp1在膜上组装成动态的螺旋、环和片层网络。a部分是AFM相位时间序列,显示Vippi被招募到高度弯曲的膜边缘。b部分是平均AFM高度图像,显示Vippi片层、螺旋和环的细。c部分是图a中虚线框的放大。d部分显示Vippi片层和螺旋/环形成并定位于膜边缘。e显示Vippi从膜边缘脱落。g部分是相位时间序列,显示密集的片层、螺旋和环网络最终覆盖整个膜平面。h部分是六张AFM高度图像的平均值。i部分量化了Vippi丝状结构和螺旋/环高度相对于膜边缘的情况。
为详细研究Vipp1螺旋形成环的具体过程、环的特征以及环与膜的相互作用特性。作者通过F-AFM观察Vipp1螺旋和环的形成过程,并对环的高度、直径等参数进行量化分析。结果表明,Vipp1螺旋在成熟过程中,环会从螺旋中心突出并脱离,环的高度、直径等参数具有特定的分布范围。Vipp1高盐条件下纯化的环(Vipp1ringsHS)能够扫描膜表面并结合受损区域,其形状和尺寸与低盐条件下形成的环(Vipp1ringsLS)相似。Vipp1螺旋在成熟过程中会形成突出的中央环并脱离,且不同条件下形成的环具有相似的结构和功能,Vipp1环能够扫描并结合受损膜区域。
图3:Vipp1螺旋形成突出的中央环并脱离。a.显示环的生物发生从一个外旋螺旋开始。b.显示螺旋和环的成熟与从膜上增加的丝状物偏移相关。c.量化了Vippi环与周围螺旋丝状物的高度差。d.展示了螺旋和环生物发生路径的示意图。e.显示单个环的F-AFM高度图像,右侧显示观察到的不同类型的Vippi环。f.量化了Vippi环直径。g.显示F-AFM相位图像,Vippi环扫描并稳定结合高度弯曲或破裂的膜。h.量化了Vippi环(红色)和环(蓝色)的高度轮廓。
为分析在低盐条件下Vipp1片层和螺旋丝的超微结构,探究二者之间的内在联系。作者利用较低速度的AFM观察Vipp1片层和螺旋丝的结构,将Vipp1暴露于脂质单层进行研究,并对相关结构进行量化分析。Vipp1片层呈现出平行条纹或脊,间距为54 ?,螺旋丝也有相同间距的平行脊,且相邻螺旋圈有时会融合。在脂质单层上,Vipp1的三维聚合物有时会结合在表面,形成的丝状结构可融合成更宽的片层,环通常位于螺旋中心。Vipp1螺旋丝和平面片层具有等效的超微结构,54?的重复结构是其聚合物组装的关键组成部分,且二者在不同条件下可以相互转换。
图4:Vipp1平面片层和螺旋丝具有密切相关的晶格。a. 原子力显微镜(AFM)高度图像显示 Vippi 中高度有序的平面片层。b. AFM 相位图像显示 Vippi 螺旋丝状物。c. NS EM 图像显示 Vippi 在脂质单层上形成的二维平面螺旋和片层的镶嵌结构。d. NS EM 图像显示 Vippi 在脂质单层上形成的二维平面螺旋和片层的镶嵌结构。
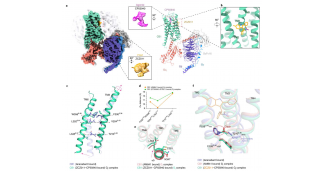
为确定Vipp1螺旋丝的结构,并探究其与Vipp1环在结构上的内在联系和相互关系。作者通过冷冻电镜(Cryo-EM)确定四种Vipp1螺旋丝的结构,包括Vipp1、Vipp1-F197K/L200K、Vipp1Δα6_1-219形成的螺旋丝,并进行详细的结构分析。Vipp1螺旋丝的亚基通过相似的界面自组装,与Vipp1ringsHS的聚合界面相似,形成ESCRT-III样原丝,这些原丝构成了螺旋丝的结构。不同Vipp1螺旋丝的结构存在差异,Vipp1Δα6_1-219形成的螺旋丝更稳定。Vipp1螺旋丝和环聚合物之间存在紧密的联系,相对较小的组装动力学调整有助于这些聚合物类型之间的转换,且Vipp1Δα6_1-219突变体影响Vipp1的聚合和结构。
图5:Vipp1Δα6_1-219螺旋丝的晶格与Vipp1环密切相关
为研究Vipp1F197K/L200K突变对其结构和膜结合的影响,以及Vipp1螺旋和环聚合物在结合膜时的差异和转换机制。作者对Vipp1F197K/L200K突变体进行Cryo-EM分析,观察其与膜的相互作用,并与Vipp1进行对比研究。Vipp1F197K/L200K突变体形成长螺旋丝,常带有膜泡帽,其内部腔室存在脂质双层。与Vipp1环相比,Vipp1F197K/L200K的ESCRT-III样原丝相对于膜管轴旋转了约43°,且为适应膜平面的相对变化,单个亚基发生了显著的构象变化。Vipp1晶格可通过不同的晶格取向使膜沿同一轴管状化,螺旋和环构象之间的转换是由晶格旋转和丝扭转引起的,而非形成新的聚合物形式。
图6:Vipp1F197K/L200K_L1发生收缩并使膜管状化
综合前面的实验结果,构建Vipp1螺旋形成、环生物发生和膜修复的机制模型,全面阐述其在膜相关过程中的作用机制。提出Vipp1螺旋形成、环生物发生的模型,以及其在膜传感、稳定和修复中的作用机制。Vipp1可通过多种方式稳定和修复膜,如形成螺旋和环结构、退火形成片层等。明确了Vipp1在膜稳定和修复中的多种作用机制,包括作为膜传感器、形成不同聚合物结构来稳定和修复膜等,这对于理解蓝藻和叶绿体中膜的维持和修复机制具有至关重要的意义。鉴于Vipp1与其他ESCRT-III蛋白具有同源性,该研究结果可能适用于其他ESCRT-III系统,有助于深入探究细胞内的膜重塑过程。在未来的研究中,这些发现可能为开发针对膜相关疾病的治疗策略提供理论基础,也为研究生物膜的稳定性和修复机制开拓了新的视角和思路。
图7:Vipp1螺旋形成、环生物发生和膜修复的机制。a. 从Vipp1Δα6_L3螺旋结构中提取的四个类似ESCRT-III的原纤维部分,显示了螺旋的结合如何促进膜在相对平面的扭转。b. Vippl平面片层、螺旋和3D环生物发生的模型。c. Vippl介导的膜感应、稳定、修复和3D环生物发生的机制。
高速原子力显微镜(F-AFM)在传统AFM基础上,对仪器的扫描速度、检测系统等进行了改进,从而实现了更高的时间分辨率,能够实时观察生物分子或材料在动态过程中的变化。F-AFM在生物物理、材料科学等众多领域都具有不可替代的重要意义。在生物物理研究中,它能够在生理条件下对生物分子的动态行为进行高分辨率成像,例如实时观察蛋白质的折叠、组装和解聚过程,以及生物分子与生物膜的相互作用等。与其他显微镜技术相比,F-AFM不仅能够提供更为详细的分子结构和动力学信息,而且对样品的制备要求相对较低,能够在接近生理环境的条件下进行观察,这对于研究生物分子的真实功能至关重要。在材料科学领域,F-AFM可用于研究材料表面的微观结构和力学性质,以及材料在不同环境下的动态变化,为材料的设计和优化提供关键依据。
在本文的研究中,F-AFM发挥了重要的作用。它被用于观察Vipp1在膜上的动态组装过程,凭借其高时空分辨率的优势,为研究人员提供了清晰的图像,使他们能够详细解析Vipp1在膜边缘的行为。实验结果显示,F-AFM清晰地观察到Vipp1在膜边缘积累并形成动态的平面丝,这些丝卷曲形成螺旋或环,详细揭示了Vipp1组装的动态过程和结构特征。通过F-AFM还对Vipp1组装形成的螺旋、环和片层的尺寸、高度等参数进行了精确量化分析,为后续的结构和功能研究提供了重要的数据支持。此外,F-AFM还用于研究Vipp1环与膜的相互作用,发现Vipp1ringsHS能够扫描膜表面并结合受损区域,进一步揭示了Vipp1在膜修复中的作用机制。
原文链接:
https://www.nature.com/articles/s41594-024-01401-8
所推广产品图片/官网链接:
https://www.bruker.com/en/products-and-solutions/microscopes/bioafm/jpk-nanowizard-ultra-speed-3.html
本研究中所用的高速原子力显微镜是部的生物型原子力显微镜。布鲁克的 NanoWizard? ULTRA Speed 3 生物原子力显微镜 (BioAFM) 在速度和性能方面树立了新的标杆。该仪器集成了先进的自动化功能和每秒 1,400 条扫描线的扫描速度,能够无缝集成到先进的光学显微镜和超分辨率技术中。该系统提供了相关样品测量以及对广泛软物质和活体生物样品的全面纳米力学表征。其自动化的快速扫描和分析功能极大地提高了通量及灵敏度、可靠性和测量精度。
全部评论(0条)
 德国布鲁克 双焦面实时超高分辨系统Bruker3DVutura
德国布鲁克 双焦面实时超高分辨系统Bruker3DVutura
报价:面议 已咨询 4918次
 德国布鲁克 多功能双光子成像平台Bruker2pplus
德国布鲁克 多功能双光子成像平台Bruker2pplus
报价:面议 已咨询 5797次
 德国布鲁克 高品质双光子成像系统BrukerInvestigator
德国布鲁克 高品质双光子成像系统BrukerInvestigator
报价:面议 已咨询 5718次
 德国布鲁克 场扫描共聚焦成像系统BrukerOpterra II
德国布鲁克 场扫描共聚焦成像系统BrukerOpterra II
报价:面议 已咨询 4837次
 德国布鲁克生物型原子力显微镜BioScope Resolve
德国布鲁克生物型原子力显微镜BioScope Resolve
报价:面议 已咨询 5440次
 德国布鲁克 布鲁克原子力显微镜Dimension FastScan
德国布鲁克 布鲁克原子力显微镜Dimension FastScan
报价:面议 已咨询 5212次
 德国布鲁克 扫描探针显微镜系统Dimension Edge
德国布鲁克 扫描探针显微镜系统Dimension Edge
报价:面议 已咨询 5217次
 德国布鲁克 扫描探针显微系统Dimension Icon
德国布鲁克 扫描探针显微系统Dimension Icon
报价:面议 已咨询 5092次









①本文由仪器网入驻的作者或注册的会员撰写并发布,观点仅代表作者本人,不代表仪器网立场。若内容侵犯到您的合法权益,请及时告诉,我们立即通知作者,并马上删除。
②凡本网注明"来源:仪器网"的所有作品,版权均属于仪器网,转载时须经本网同意,并请注明仪器网(www.yiqi.com)。
③本网转载并注明来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
④若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi
参与评论
登录后参与评论