用于间质液生物标志物提取和比色检测的3D打印水凝胶微针阵列
摘要:为了治疗和管理慢性疾病,有必要持续监测相关生物标志物,并随着疾病状态的变化调整治 疗方法。与其他体液相比, 间质皮肤液(ISF)是鉴定生物标志物的一个很好的选择, 因为它具有与 血浆Z相似的分子组成。提出了一种无痛、无血提取ISF的微针阵列(MNA)。MNA由交联聚乙二醇二 丙烯酸酯(PEGDA)制成,并提出了力学性能和吸收性能的Z佳平衡。此外,还研究了针的横截面形 状对皮肤穿透的影响。MNA集成了一个多路传感器,该传感器基于pH和葡萄糖生物标志物比色检测 的相关反应, 以生物标志物浓度依赖的方式提供颜色变化。开发的设备可以通过目视检查或定量红 、绿、蓝(RGB)分析进行诊断。这项研究的结果表明,MNA可以在几分钟内成功识别间质皮肤液中的 生物标志物。基于家庭的代谢性疾病的长期监测和管理将受益于这种实用和自我管理的生物标志物 检测。
1. 序言
慢性疾病的治疗和管理需要持续监测相关生物标志物,以便随着疾病状态的变化调整治![]()
![]() 疗[1–3]。传统的生物标志物检测方法是基于侵入性血液采样和相关的实验室检测[4]。为了解决血液采样的侵入性问题,已经开发出可以检测尿液、眼泪、汗液和唾液中的生物标志物的 传感器[5–7]。然而,上述体液中可用的生物标志物的浓度和动态是有限的,并且与它们在血 液中的存在相关性很差,因此它们通常具有较低的诊断相关性[8,9]。透皮生物传感器通过分 析真pi层Z下层皮肤层的间质液(ISF)来检测生物标志物[10– 12]。与其他体液相比,间质液具 有与血浆Z相似的分子组成[13],此外还具有其他独特的特征,如与医学相关的生物标志物 [10,14]。由血液经毛细血管过滤产生的真pi组织间质液是一种有吸引力的生物标志物来源, 因为其80%的成分与血浆共享,并且它含有特定的独特生物标志物,特别是某些疾病,如黑色素瘤[15,16]。此外,ISF中存在的一些生物标志物在血浆中是不存在的[17]。透皮生物传感 允许对患者健康状况进行无创或微创的连续监测,这可以使我们更接近个性化和精准医疗[10,18,19]。
疗[1–3]。传统的生物标志物检测方法是基于侵入性血液采样和相关的实验室检测[4]。为了解决血液采样的侵入性问题,已经开发出可以检测尿液、眼泪、汗液和唾液中的生物标志物的 传感器[5–7]。然而,上述体液中可用的生物标志物的浓度和动态是有限的,并且与它们在血 液中的存在相关性很差,因此它们通常具有较低的诊断相关性[8,9]。透皮生物传感器通过分 析真pi层Z下层皮肤层的间质液(ISF)来检测生物标志物[10– 12]。与其他体液相比,间质液具 有与血浆Z相似的分子组成[13],此外还具有其他独特的特征,如与医学相关的生物标志物 [10,14]。由血液经毛细血管过滤产生的真pi组织间质液是一种有吸引力的生物标志物来源, 因为其80%的成分与血浆共享,并且它含有特定的独特生物标志物,特别是某些疾病,如黑色素瘤[15,16]。此外,ISF中存在的一些生物标志物在血浆中是不存在的[17]。透皮生物传感 允许对患者健康状况进行无创或微创的连续监测,这可以使我们更接近个性化和精准医疗[10,18,19]。
ISF取样技术有限, 包括吸泡、微透析、开流微灌注、反向离子透入和微针贴片[14, 20]。然而,像吸泡这样的手术很复杂,经常会引起患者不适,并有感染的潜在风险。Z 近,微针阵列(MNAs)在提取皮肤ISF方面显示出巨大的潜力并取得了一些成功[12]。使用 微针阵列设备提取和分析ISF可以在护理点环境中进行微创患者健康监测。对间质液进行 全面分析的简单有效的方法可以在诊断实践中带来改变游戏规则的进步。这些方法不仅 无痛、微创,而且也适用于即时护理和资源受限的环境[18]。然而, 由于角质层(SC)屏障 是皮肤的外层, ISF代谢物不容易渗透到皮肤表面进行测试[21]。因此,采用吸泡技术去除ISF进行分析,这只能由有资质的专家在诊所进行,并且可能导致不适甚至感染[14]。
已经开发出微针(MNs),它可以以很小的侵入性穿透SC,并通过毛细力或真空吸力提取 ISF[22–25]。基于微针的技术已被认为是提取基本ISF的有效方法,具有诊断整合的潜力[26–29]。
不同类型的MNAs使用不同的方法提取皮肤间质液。空心纳米管基于负压工作 [26,30];多 孔MNs利用毛细力[26,30];Z近,基于水凝胶的MNAs使用材料吸收[11,26]。与皮下注射针头相 比,基于水凝胶的MNAs具有更短的长度和更锋利的尖端,可以有效地穿透皮肤SC并形成微尺度 的间质液提取通道[18]。与其他MNAs相比,基于水凝胶的MNAs具有几个优势,例如改进和更快 的ISF提取,出色的生物相容性,更便宜的制造成本,更高的产量,Z重要的是,插入和移除方便 而不伤害皮肤[12,26,31–33]。将生物传感器附着在纳米颗粒上,可以对组织液进行原位表征[11, 12]。可膨胀聚合物纳米颗粒也被证明对ISF吸收有效[34]。虽然微针阵列应用简单,但目前的方 法需要较长的采样周期以及额外的操作和分析设备[35]。证明了具有增强膨胀能力的MNAs[10,12 ,33],其中利用离心机提取吸附的ISF,并且需要实验室仪器进行离线分析。一项新的研究使用抗 体包被的聚苯乙烯MNAs[捕获ISF中的蛋白质生物标志物,用于离线酶联免疫吸附测定,灵敏度显 著提高 [36]。然而,MNs的功能化和对荧光免疫分析的微孔板阅读器的要求使这一过程复杂化。 Z近,有人尝试将酶和染料分子插入到MNs[中,用于高血糖的比色检测,以实现即时诊断[37] 。 另一方面,感应试剂和MNAs酶促反应产生的副产物泄漏到皮肤中是一个大问题[38,39]。虽然已 经证明,在基于MNA的比色葡萄糖传感器中,将葡萄糖氧化酶偶联在纳米颗粒上可以防止酶逃逸 到皮肤组织中,但不能避免染料分子和H2O2的泄漏,这增加了MNA制造的复杂性[40]。然而,大 多数基于MNA的诊断技术要么是复杂的制造过程,要么是ISF后处理[18]。Z近的研究主要集中在 具有实时电跟踪健康状况能力的水凝胶形成纳米颗粒上。演示了导电水凝胶微针阵列电极,允许 在不需要后处理的情况下进行针上pH传感。MNA的制备涉及使用可膨胀的多巴胺共轭透明质酸 水凝胶包埋聚(3,4-乙烯-二氧噻吩):聚苯乙烯磺酸盐(PEDOT: PSS)来提高电导率。利用多巴胺 固有的儿茶酚-醌化学来测量间质液的pH值。研究了PEDOT: PSS对MNA阵列的机械强度和膨胀 能力的影响[41]。针上传感装置存在一些风险,如所需传感试剂与皮肤组织直接接触会造成健康 风险。打印分辨率、特征精度的提高以及新打印材料的可用性使得三维(3D)打印能够制造不 同类型的网状结构[42–45]。三维打印技术可以制造比传统方法更复杂的MN结构[46]。利用 3D打印技术可以一步制作出各种结构的网状结构,3D打印机的高分辨率保证了阵列的细
节形成[47]。
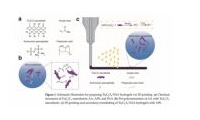
为了解决上述问题,本文提出了用于多重透皮代谢物检测的3d打印比色MNAs 。MNs 由交联聚乙二醇二丙烯酸酯(PEGDA)组成,具有良好的机械强度和可膨胀性。PEGDA是一 种生物相容性水凝胶[48]。所应用的传感器是可拆卸的,可以原位、实时比色检测代谢物 , 并报告ISF中葡萄糖的pH和浓度。本研究旨在探讨PEGDA水凝胶MNAs用于ISF检测应用 的可行性,并寻找Z佳规格。在这方面,评估了使用3D打印工艺制造的MNAs,然后评估 了不同规格的MNAs在液体提取和皮肤渗透以及比色传感方面的能力。在此基础上,提出 了具有Z佳规格的MNA。通过提供自我管理的ISF生物标志物的连续监测,该技术适用于高效的家庭使用,患者依从性高,为安全和长期监测和慢性疾病的Z佳管理提供了前景。水凝胶微针阵列的制备和应用过程如图1所示。
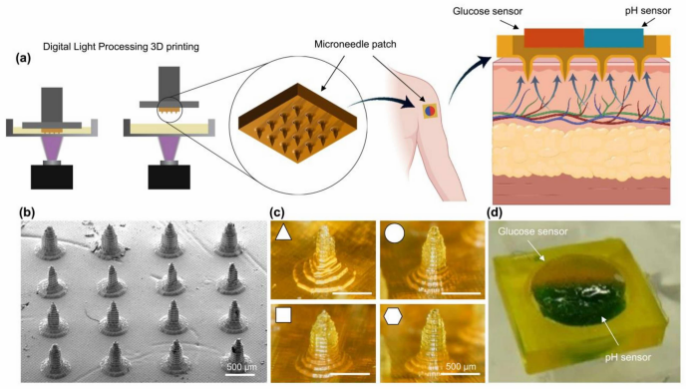
图1 。(a)基于水凝胶的微针贴片的应用过程示意图;(b) MNA扫描电子显微镜(SEM)图像;(c)不同截面
的印刷微针;(d)微针贴片。
2. 结果与讨论
2.1. 使用3D打印制造MNAs
采用数字光处理(DLP)生物打印方法制备MNAs。生物打印的过程如图2a所示。利用计 算机辅助设计(CAD)软件生成MN阵列(4 × 4)的三维模型。通过数字技术,3D模型被切割 成几个横截面图像。每个数字图像被发送到数字微镜装置(DMD),该装置产生图案光(405 nm),然后通过投影透镜发送并集中在光固化前驱体溶液的表面。投影光将液体光固化前 驱体溶液转化为固体图案层。为了创建一个三维MNA,这个过程被一层一层地重复。本研 究以分子量为700 Da的PEGDA (PEGDA 700)为单体,酒黄为光吸收剂,苯-2,4,6三甲基苯甲酰膦酸锂(LAP)为光引发剂。
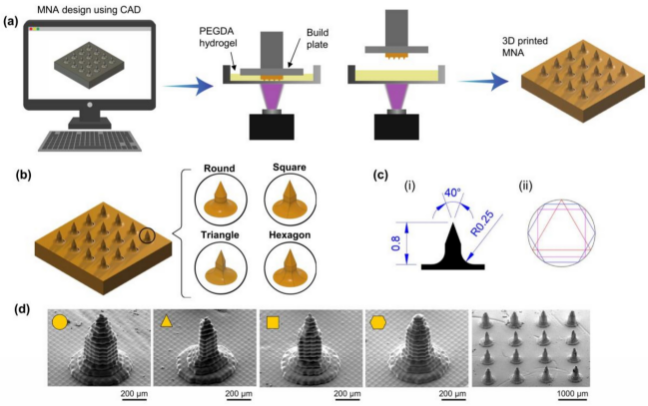
图2 。微针阵列的制备工艺。(a) MNAs的DLP打印示意图;(b)不同截面形状的MNAs的CAD设计;(c)针 的尺寸,(i)针的高度、针尖角度和角半径,(ii)不同形状的针截面的比较;(d)不同截面形状的打印微针的SEM图像。
设计并制备了圆形、三角形、正方形和六边形截面形状的MNAs, 以研究其性能和表 征。MNAs的设计长度为800µm,锥角为40°, 如图2c所示。SEM图像(图2d)显示,不同 截面形状的MNAs具有合适的结构。不同PEGDA浓度的MNAs也被3D打印出来,从15%到85%不等。
为了在尺寸上比较设计的MNAs和打印的MNAs, 3D打印了不同截面形状的MNAs,高度为 800µm,直径为300µm(包围圆),直径为200、300和400µm的圆形MNAs。图3显示了MNA的测量结果。结果表明,所制备的MNAs具有良好的尺寸精度。
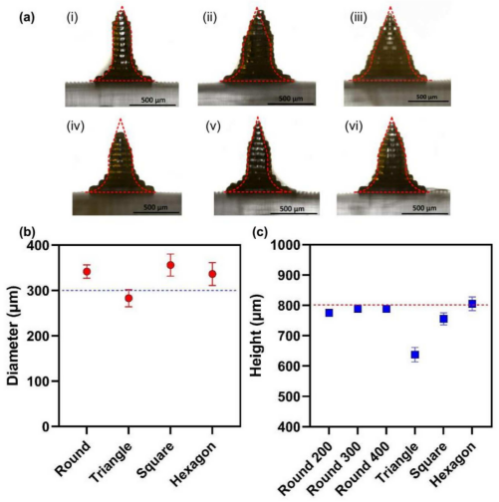
图3 。(a)设计和印刷MN的图形尺寸比较,(i)直径200µm的圆形MN , (ii)直径300µm的圆形MN , (iii)直径400µm的圆形MN , (iv)直径300µm的三角形截面MN , (v)直径300µm的方形截面MN, (vi)直径300µm的六边形截面MN;(b)设计的微球直径与公称直径比较图;(c)设计的微尘高度与标称 高度比较图。
2.2. 膨胀特性
不可溶解的水凝胶基MNAs如果高度可膨胀,则可用于提取ISF的快速和显著吸收以 进行比色分析。为了研究溶胀性能,3D打印了不同浓度PEGDA的MNAs,浓度从15%到85%不等。表1显示了不同配方的MNAs的组成。使用磷酸盐缓冲盐水(PBS)溶液研究MNAs提取ISF的能力。将不同浓度PEGDA的MNAs置于PBS溶液中10分钟,测量针直径 的增加,作为液体吸收和肿胀的指标。所有五种不同的3d打印微针都浸泡在PBS中, 以 确定随着时间的推移针头直径的变化。一个更显著的直径变化可以作为一个指标,为更 高的排汗性能的能力。重量变化越快,表明微针阵列的液体吸收越快。图4a显示了15% PEGDA微针在开始和浸泡1分钟和2分钟后的针径变化。图4b还描绘了所有样品浸泡10分钟后直径的变化。由于MNAs具有较高的溶胀性,在PBS中浸泡几分钟后就会饱和。
表1 。研究不同配方的MNAs的膨胀特性。
材料 |
15% |
32.50% | 配方 50% |
67.50% |
85% |
PEGDA (vol%) | 15 | 32.5 | 50 | 67.5 | 85 |
LAP (wt%) | 0.3 | 0.3 | 0.3 | 0.3 | 0.3 |
Tartrazine (mM) | 2.5 | 2.5 | 2.5 | 2.5 | 2.5 |
Distilled water (vol%) | 85 | 67.5 | 50 | 32.5 | 15 |
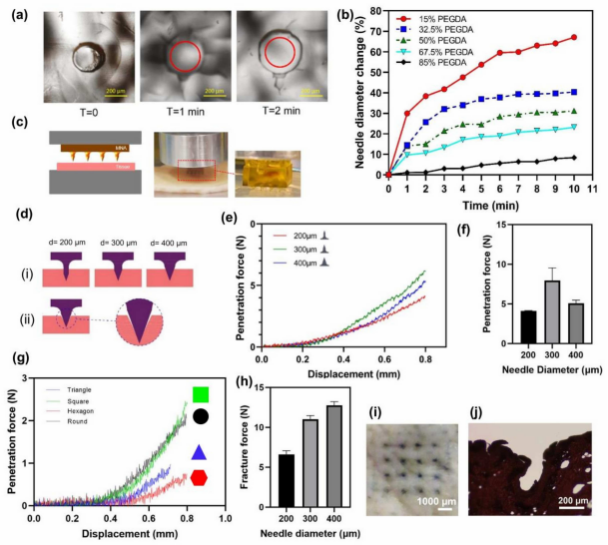
图4 。膨胀和机械性能。(a,b)溶胀试验不同时间MN直径变化情况;(c)机械测试装置;(d)不同直径的纳 米颗粒穿透示意图;(e)不同直径的圆形MNAs的穿透力与位移的关系;(f)不同直径的圆形MNAs的Z大 穿透力;(g)不同截面形状的MNAs的穿透力;(h)不同针径MNAs的断裂力;(i)用蓝色染料插入MNA后的猪皮俯视图;j) MNA穿透的猪皮染色切片。
MNAs的膨胀特性与其材料有关。降低MNAs中PEGDA的浓度导致密度降低,并提供更多的空间来吸收更多的水。从图4b中可以看出,PEGDA浓度为15%的MNA,其针径增 加了67.1%左右,显示出较高的溶胀性,而PEGDA浓度为85%的MNA,其针径在10 min内增加了8.4%左右。
2.3. 机械性能
使用MNAs作为比色检测装置所需的另一个特性是良好的机械性能,足以穿透皮肤。为 了评估MNAs的力学性能,使用了压缩力学测试系统(图4c),其中测量了MNAs在猪皮中渗 透所需的力。PEGDA浓度低于50% (15%和32.5%)制备的MNAs穿透实验失败。采用针直 径为200µm 、300µm和400µm的机械测试MNAs来评估针直径对穿透力的影响。结果表 明,针径为300µm的MNA比针径为200µm和400µm的MNA具有更高的穿透力。很明显, 穿透力是在穿透过程中与组织接触的面积的函数。预计随着针径的增大,穿透力增大。针径 为300µm的MNA穿透力比针径为400µm的MNA穿透力大。图4d显示了不同针径的MNAs 的穿透示意图。从图4d (ii)可以看出,在针尖区域,尖锐的边缘会减少针头与组织的接触面积。这可能是400 μ m针头直径的MNA比300 μ m针头直径的MNA穿透力更小的原因,因为它具有更高的尖端角面积,并且减少了剩余针头的外部针头面积。
研究了针截面形状对刺入力的影响。直径为300µm,横截面形状为圆形、六边形、正方 形和三角形的MNAs被用于本研究。穿透力似乎是两个参数的函数:针接触面积和截面形状顶 点的数量。随着针与组织接触面积的增加,穿透性也随之增加。此外,穿透力随着截面形状 顶点数的增加而减小[49]。表2显示了具有不同截面形状的MNAs的接触周长值(作为接触面积的指标)和顶点数。结果表明,针径为200µm的六边形截面穿刺力较小。
表2 。不同截面形状的MNAs的接触周长和顶点数。
横截面形状 | 横截面周长(mm2 ) | 顶点数 |
圆形 | 1.885 | 0 |
三角形 | 1.559 | 3 |
正方形 | 1.697 | 4 |
六边形 | 1.8 | 6 |
图4h为不同针径下PEGDA浓度为85%的MNAs的断裂力。测得的断裂力在6.3 ~ 13.1 N之间,结果表明,MNAs的断裂力大于其相应的穿透力,表明其可以安全穿透皮肤。其他 研究也报道了3d打印的MNAs的断裂力在2到10 N之间[50]。图4i、图j也分别显示了用蓝色
染料插入MNA后的猪皮俯视图,以及MNA穿透后的猪皮染色切片。
2.4. 传感
利用pH和葡萄糖两种生物标志物评估了MNAs的传感特性。生理pH监测在临床实 践中非常重要,因为它提供了有关人体调节系统的信息[51]。生理pH值的微小变化可对 细胞、组织和器官功能产生影响,因此可用于早期发现疾病[51]。监测组织和器官的pH值对于许多疾病的诊断至关重要[41]。在这项研究中,pH值范围为7.0至10.0,用MNAs比色法检测。MNA传感器在检测不同pH值时颜色变化的代表图像以及红、绿、蓝(RGB)百分比(蓝色)的相关变化如图5a所示。

图5 。(a) pH值感应的RGB颜色百分比变化;(b)葡萄糖传感的RGB颜色百分比变化;(c) 50% PEGDA MNA的细胞活力检测结果
正常空腹血糖水平在3.9 - 6.1 mM之间,健康人饭后2小时可升至7.9 mM。糖尿病 患者空腹血糖水平超过7.0 mM,餐后2小时血糖水平超过11.1 mM[25]。有效管理糖尿病 的关键是及时监测不同的血糖水平。然而, 由于患者依从性差,传统的手指穿刺血液检查 不适合频繁使用。另一种选择是无痛、无血的微针技术。葡萄糖浓度范围从0到12 mM使 用MNAs测量。图5b为MNA传感器检测不同浓度葡萄糖时颜色变化的代表性图像,RGB百分比(红色)的相关变化如图5a所示。
2.5. 细胞毒性
类似于本研究的材料已被用于MNAs的药物递送应用,并且可能被认为是非细胞毒性 的 [46,52-54]。虽然这些材料通常被认为是安全的,但必须评估其在应用浓度下的细胞毒 性, 以确保其在医学研究和临床应用中的安全性。建议的配方(50% PEGDA)为此目的使用 细胞活力测定实验进行评估。测试结果表明,测试材料可用于制造用于检测应用的MNAs。如图5c所示,与孵育第一天相比,7天后细胞活力的下降没有统计学意义。
3. 总结
我们展示了3D打印PEGDA微针可用于提取皮肤ISF和检测生物标志物。考察了PEGDA 浓度和针径对机械强度和提取性能的影响,提出了Z佳MNA规格。MNA包括一个多路传感 器,用于原位比色检测提取的间质液中的多种生物标志物(特别是pH和葡萄糖)。微针贴片 使用简单,可以用肉眼检测。安装了专门开发的应用程序的智能手机可用于定量RGB分析 。其他代谢物(如胆固醇和乳酸)也可以用同样的方法进行测试。该装置具有在慢性病医疗 实践中应用的潜力。
基于这些结果,我们建议使用一种六边形横截面形状、PEGDA浓度为50%的微针进行检测,因为它比本研究中其他可能的MNAs需要更低的穿透力和更高的吸收能力。
4. 材料与方法
4.1. 材料
PEGDA (Mw 700 Da) 、LAP、酒黄、溴甲酚绿、α-萘酞粉、葡萄糖、辣根过氧化物酶、葡萄糖氧化酶、碘化钾、海藻糖、柠檬酸钠和Dowex 1 × 4氯泡沫珠购自Sigma-Aldrich (St. Louis, MO, USA)。胎牛血清(FBS)、磷酸盐缓冲盐水(PBS)和Dulbecco改良Eagle培养基(DMEM)购自ibco (Grand Island, NE, USA) 。Presto蓝(PB)试剂购自Invitrogen公司(A13261, Waltham, MA, USA)。柠檬酸钠购自VWR, Radnor, PA, USA。
4.2. 研究设计
本研究旨在探讨PEGDA水凝胶MNAs用于ISF检测的可行性,并为其寻找Z佳规格。在 这方面,评估了使用3D打印工艺制造的MNAs,然后评估了不同规格的MNAs在液体提取和皮肤渗透以及比色传感方面的能力。在此基础上,提出了具有Z佳规格的MNA。
4.3. MNAs的制备
为了制备PEGDA基生物墨水,将0.3 wt%的LAP和2.5 mM的酒黄(Z终生物墨水的浓 度)溶解在蒸馏水中,然后将所需量的PEGDA加入到溶液中。生物墨水在打印前要摇晃。使 用Cellink Co. (Gothenburg, Sweden)生产的Lumen-X DLP生物打印机打印MNAs。打印后,用蒸馏水冲洗MNAs,并在室温下空气干燥。
4.4. pH敏感微珠的合成
α-萘酞粉末在100%乙醇中溶解,在15ml锥形容器中得到100mg /mL的原液。在溶 液中滴入1M NaOH,必要时将染料全部加入。接下来,将400 g Dowex树脂悬浮在500 mL烧杯中的400 mL蒸馏水中。在用玻璃搅拌棒不断搅拌Dowex溶液的同时,用移液管滴 入染料原液至Z终浓度为2mg染料/ 1g珠。树脂被允许不受干扰地坐着,直到它沉降到烧 杯底部(大约10-15分钟)。然后用26毫升注射器从烧杯中取出尽可能多的水。珠子在蒸馏 水中重复此过程洗涤3次。在Z后的洗涤后,珠子被转移到一个大小25目织物筛放置在一
个漏斗定位在废物烧杯。让它们排干大约1-2分钟。然后将珠子和网片移到几张纸巾上,以帮助它们进一步排干。干燥后,珠子被储存在室温下的密封罐中。
4.5. 葡萄糖敏感微球的合成
将6 mg葡萄糖氧化酶、0.6 mg辣根过氧化物酶、498 mg碘化钾和513 mg海藻糖 溶于5 mL柠檬酸钠缓冲液 (pH 6)中,制备葡萄糖敏感溶液。然后用蒸馏水洗涤2000mg Dowex 1 × 4氯泡沫珠3次,无水乙醇洗涤1次。随后,抽吸乙醇,用葡萄糖敏感溶液代 替,在4℃下孵育过夜,使染料与珠结合。抽吸溶液,用蒸馏水洗涤4次,留下葡萄糖敏感珠。
4.6. 比色传感器的制造
使用3D打印模具将染料负载珠形成片剂形状。采用分离器制备两珠片(图S1)。
4.7. 膨胀试验
用PBS溶液考察MNAs提取ISF的能力。将不同PEGDA浓度的MNAs置于PBS溶液中10分钟,测量针直径的增加,作为液体吸收和膨胀的指标。
4.8. 渗透试验
机械强度测试采用定制的压缩试验装置进行。绘制不同针径和不同横截面形状的MNAs刺入猪皮,刺入力随位移的变化规律。
4.9. 传感试验
使用带空腔的聚二甲基硅氧烷(PDMS)模具(图1d)来研究对MNAs的传感。在空腔中分 别填充pH溶液(氢氧化钠或溴甲酚绿)和葡萄糖,进行pH和葡萄糖传感实验。将MNAs放置 在空腔中, 以便将针放入溶液中。MNA吸收溶液后,溶液到达传感器,用Image J 软件捕获并分析颜色变化图像,绘制RGBs图。
4.10. 细胞活力测定
在96孔板中,每孔10000个细胞,将3d打印的水凝胶基MNAs在0.2 mL培养基中培 养24小时, 以测定其细胞活力。通过监测活细胞的代谢活性,Presto blue (PB)试验被用 作快速评估各种细胞类型的活力和增殖的标准程序。为了评估实验样品的细胞活力,采用 间接提取法。将3d打印的MNAs在1 mL含有10% v/v FBS的DMEM中孵育1 、3 、5和7天 , 温度为37℃, 二氧化碳浓度为5%,空气完全湿润。每隔一段时间,收集500 L提取液 用于PB测定,并替换为新鲜的DMEM + FBS溶液。每个周期采集的提取物分别给予细胞 200µL,孵育24 h。然后用PB细胞活力试剂测定细胞的代谢活性。在DMEM溶液中配制 100µL体积的10% PB试剂,加入每孔。将培养板孵育15min, 以560nm和590nm为激发波长和发射波长测量培养细胞的荧光强度。然后用下面的公式来确定样品的活力:细胞活力:(样品的平均荧光密度/对照的平均荧光密度)* 100。
4.11. 图像处理
应用Image J中的RGB直方图插件对应用后的MNAs光学图像进行分析。采用GraphPadPrism 9.0软件进行统计分析。
4.12. 统计分析
数据以平均值和标准差(SD)表示。采用单因素方差分析(ANOVA)进行统计分析。p值小于0.05被认为具有统计学意义。
补充资料: 以下支持资料可从以下网站下载:https://www.mdpi.com/article/10.3390/polym15061389/s1。图S1:用于制作多路复用传感器的3D打印设备组。
供稿作者:Conceptualization, M.R. and M.A.; methodology, M.R., A.S. and E.P.; soft-ware, M.R. and E.P.; validation, A.H.N. and M.A.; formal analysis, M.R.; investigation, M.R., A.S.and E.A.; resources, M.A.; data curation, M.R. and A.S.; writing—original draft preparation, M.R.;writing— review and editing, M.R.; visualization, M.R., A.S., E.P. and E.A.; supervision, A.H.N. andM.A.;
project administration, M.A.; funding acquisition, M.A. All authors have read and agreed to the published version of the manuscript.
资金:这项研究得到了加拿大自然科学与工程研究委员会 (NSERC)、国际修复发现合作组织
(ICORD)、加拿大卫生研究院(CIHR)和加拿大创新基金会(CFI)的支持。
机构审查委员会声明:不适用。
知情同意声明:不适用。
数据可用性声明:本研究中提供的数据可向通讯作者索取。由于隐私限制,这些数据不会公开。
致谢:作者感谢“维多利亚大学生物力学和仪器实验室”的Aaron Brice使用了材料试验机和数据采
集。
利益冲突:作者声明无利益冲突。
缩写词 | |||
3D | 3-dimensional | MNA | Microneedle array |
CAD | Computer-aided design | PB | Presto Blue |
DLP | Digital light processing | PBS | Phosphate-buffered saline |
DMD | Digital micromirror device | PDMS | Polydimethylsiloxane |
DMEM | Dulbecco’s modiied eagle medium | PEGDA | Poly(ethylene glycol) diacrylate |
FBS | Fetal bovine serum | RGB | Red, green, blue |
ISF | Interstitial luid | SC | Stratum corneum |
LAP | Lithium phenyl-2,4, 6-trimethylbenzoylphosphinate | SD | Standard deviation |
MN | Microneedle | SEM | Scanning electron microscopy |
References
1. Chen, X.; Dong, T.; Wei, X.; Yang, Z.; Pires, N.M.M.; Ren,J.; Jiang, Z. Electrochemical methods for detection of biomarkers of Chronic Obstructive Pulmonary Disease in serum and saliva. Biosens. Bioelectron. 2019, 142, 111453. [CrossRef] [PubMed]
2. Hong, Y.; Lee, S.H. Effectiveness of tele-monitoring by patient severity and intervention type in chronic obstructive pulmonary disease patients: A systematic review and meta-analysis. Int. J. Nurs. Stud. 2019, 92, 1–15. [CrossRef] [PubMed]
3. Kukkar, D.; Zhang, D.; Jeon, B.; Kim, K.-H. Recent advances in wearable biosensors for non-invasive monitoring of speciic metabolites and electrolytes associated with chronic kidney disease: Performance evaluation and future challenges. TrAC Trends Anal. Chem. 2022, 150, 116570. [CrossRef]
4. Silva, T.E.; Ronsoni, M.F.; Schiavon, L.L. Challenges in diagnosing and monitoring diabetes inpatients with chronic liver diseases. Diabetes Metab. Syndr. Clin. Res. Rev. 2018, 12, 431–440. [CrossRef]
5. Alwan, A.; MacLean, D.R.; Riley, L.M.; D’Espaignet, E.T.; Mathers, C.D.; Stevens, G.A.; Bettcher, D. Monitoring and surveillance of chronic non-communicable diseases: Progress and capacity in high-burden countries. Lancet 2010, 376, 1861–1868. [CrossRef] [PubMed]
6. Gandhi, P.U.; Pinney, S. Management of Chronic Heart Failure: Biomarkers, Monitors, and Disease Management Programs. Ann. Glob. Health 2014, 80, 46–54. [CrossRef]
7. Mujeeb-U-Rahman, M.; Nazari, M.H.; Sencan, M. A novel semiconductor based wireless electrochemical sensing platform for chronic disease management. Biosens. Bioelectron. 2018, 124–125, 66–74. [CrossRef]
8. Mohan,A.; Rajendran,V.; Mishra, R.K.; Jayaraman,M. Recent advances and perspectives in sweat based wearable electrochemical sensors. TrAC Trends Anal. Chem. 2020, 131, 116024. [CrossRef]
9. Sanati, A.; Esmaeili, Y.; Bidram, E.; Shariati, L.; Raienia, M.; Mahshid, S.; Parlak, O. Recent advancement in electrode materials and fabrication, microluidic designs, and self-powered systems for wearable non-invasive electrochemical glucose monitoring. Appl. Mater. Today 2022, 26, 101350. [CrossRef]
10. Samant, P.P.; Niedzwiecki,M.M.; Raviele,N.; Tran,V.; Mena-Lapaix,J.; Walker, D.I.; Felner, E.I.; Jones, D.P.; Miller, G.W.; Prausnitz, M.R. Sampling interstitial luid from human skin using a microneedle patch. Sci. Transl. Med. 2020, 12, eaaw0285. [CrossRef]
11. Kashaninejad, N.; Munaz, A.; Moghadas, H.; Yadav, S.; Umer, M.; Nguyen, N.-T. Microneedle Arrays for Sampling and Sensing Skin Interstitial Fluid. Chemosensors 2021, 9, 83. [CrossRef]
12. Chang, H.; Zheng, M.; Yu, X.; Than, A.; Seeni, R.Z.; Kang, R.; Tian,J.; Khanh, D.P.; Liu, L.; Chen, P.; et al. A Swellable Microneedle Patch to Rapidly Extract Skin Interstitial Fluid for Timely Metabolic Analysis. Adv. Mater. 2017, 29, 1702243. [CrossRef]
13. Tran, B.Q.; Miller, P.R.; Taylor, R.M.; Boyd, G.; Mach, P.M.; Rosenzweig, C.N.; Baca,J.T.; Polsky, R.; Glaros, T. Proteomic charac- terization of dermal interstitial luid extracted using a novel microneedle-assisted technique. J. Proteome Res. 2018, 17, 479–485. [CrossRef]
14. Niedzwiecki, M.M.; Samant, P.; Walker, D.I.; Tran, V.; Jones, D.P.; Prausnitz, M.R.; Miller, G.W. Human Suction Blister Fluid Composition Determined Using High-Resolution Metabolomics. Anal. Chem. 2018, 90, 3786–3792. [CrossRef]
15. Shi,A.; Kasumova,G.G.; Michaud,W.A.; Cintolo-Gonzalez,J.; Díaz-Martínez,M.; Ohmura,J.; Mehta,A.; Chien, I.; Frederick, D.T.; Cohen, S.; et al. Plasma-derived extracellular vesicle analysis and deconvolution enable prediction and tracking of melanoma checkpoint blockade outcome. Sci. Adv. 2020, 6, eabb3461. [CrossRef]
16. Wang, Z.; Li, H.; Wang,J.; Chen, Z.; Chen, G.; Wen, D.; Chan, A.; Gu, Z. Transdermal colorimetric patch for hyperglycemia sensing in diabetic mice. Biomaterials 2020, 237, 119782. [CrossRef]
17. Sjöbom, U.; Christenson, K.; Hellström, A.; Nilsson, A.K. Inlammatory markers in suction blister luid: A compara-tive study between interstitial luid and plasma. Front. Immunol. 2020, 11, 597632. [CrossRef]
18. Zheng, H.; GhavamiNejad, A.; GhavamiNejad, P.; Samarikhalaj, M.; Giacca, A.; Poudineh, M. Hydrogel Mi-croneedle-Assisted Assay Integrating Aptamer Probes and Fluorescence Detection for Reagentless Biomarker Quantiication. ACS Sens. 2022, 7, 2387–2399. [CrossRef]
19. Pandey, P.C.; Shukla, S.; Skoog, S.A.; Boehm, R.D.; Narayan, R.J. Current advancements in transdermal bio-sensing and targeted drug delivery. Sensors 2019, 19, 1028. [CrossRef]
20. Chen,J.; Wang, M.; Ye, Y.; Yang, Z.; Ruan, Z.; Jin, N. Fabrication of sponge-forming microneedle patch for rapidly sampling interstitial luid for analysis. Biomed. Microdevices 2019, 21, 63. [CrossRef]
21. Ullah, S.; Hamade, F.; Bubniene, U.; Engblom,J.; Ramanavicius, A.; Ramanaviciene, A.; Ruzgas, T. In-vitro model for assessing glucose diffusion through skin. Biosens. Bioelectron. 2018, 110, 175–179. [CrossRef]
22. Cárcamo-Martínez, Á.; Mallon, B.; Domínguez-Robles,J.; Vora, L.K.; Anjani, Q.K.; Donnelly, R.F. Hollow microneedles: A perspective in biomedical applications. Int. J. Pharm. 2021, 599, 120455. [CrossRef] [PubMed]
23. Nicholas, D.; Logan, K.A.; Sheng, Y.; Gao, J.; Farrell, S.; Dixon, D.; Callan, B.; McHale, A.P.; Callan, J.F. Rapid paper based colorimetric detection of glucose using a hollow microneedle device. Int. J. Pharm. 2018, 547, 244–249. [CrossRef]
24. Than, A.; Zan, P.; Chen, P. Transdermal theranostics. View 2020, 1, e21. [CrossRef]
25. Zhu, D.D.; Zheng, L.W.; Duong, P.K.; Cheah, R.H.; Liu, X.Y.; Wong, J.R.; Wang, W.J.; Guan, S.T.T.; Zheng, X.T.; Chen, P. Colorimetric microneedle patches for multiplexed transdermal detection of metabolites. Biosens. Bioelectron. 2022, 212, 114412. [CrossRef] [PubMed]
26. Liu, G.S.; Kong, Y.; Wang, Y.; Luo, Y.; Fan, X.; Xie, X.; Yang, B.-R.; Wu, M.X. Microneedles for transdermal diagnostics: Re-cent advances and new horizons. Biomaterials 2020, 232, 119740. [CrossRef]
27. Teymourian, H.; Moonla,C.; Tehrani, F.; Vargas, E.; Aghavali, R.; Baridokht,A.; Mercier, T.T.P.P.; Dassau, E.; Wang,J. Microneedle- based detection of ketone bodies along with glucose and lactate: Toward real-time continuous interstitial luid monitoring of diabetic ketosis and ketoacidosis. Anal. Chem. 2019, 92, 2291–2300. [CrossRef]
28. Goud, K.Y.; Moonla, C.; Mishra, R.K.; Yu, C.; Narayan, R.; Litvan, I.; Wang,J. Wearable electrochemical mi-croneedle sensor for continuous monitoring of levodopa: Toward Parkinson management. ACS Sens. 2019, 4, 2196–2204. [CrossRef]
29. Serrano-Castañeda, P.; Escobar-Chávez,J.J.; Rodríguez-Cruz, I.M.; Melgoza, L.M.; Martinez-Hernandez,J. Microneedles as enhancer of drug absorption through the skin and applications in medicine and cosmetology. J. Pharm. Pharm. Sci. 2018, 21, 73–93. [CrossRef]
30. Bolton, C.J.; Howells, O.; Blayney, G.J.; Eng, P.F.; Birchall,J.C.; Gualeni, B.; Roberts, K.; Ashrafa, H.; Guyb, O.J. Hollow silicon mi-croneedle fabrication using advanced plasma etch technologies for applications in transdermal drug delivery. Lab A Chip 2020, 20, 2788–2795. [CrossRef]
31. Zhu,J.; Zhou, X.; Kim, H.J.; Qu, M.; Jiang, X.; Lee, K.; Ren, L.; Wu,Q.; Wang, C.; Zhu, X.; et al. Gelatin methacryloyl microneedle patches for minimally invasive extraction of skin interstitial luid. Small 2020, 16, 1905910. [CrossRef]
32. Ramadon, D.; McCrudden, M.T.C.; Courtenay, A.J.; Donnelly, R.F. Enhancement strategies for transdermal drug delivery systems: Current trends and applications. Drug Deliv. Transl. Res. 2021, 12, 758–791. [CrossRef]
33. Zheng, M.; Wang, Z.; Chang, H.; Wang, L.; Chew, S.W.; Lio, D.C.S.; Cui, M.; Liu, L.; Tee, B.C.K.; Xu, C. Osmosis-powered hydrogel mi-croneedles for microliters of skin interstitial luid extraction within minutes. Adv. Healthc. Mater. 2020, 9, 1901683. [CrossRef]
34. Yadav, P.R.; Dobson, L.J.; Pattanayek, S.K.; Das, D.B. Swellable microneedles based transdermal drug delivery: Mathematical model development and numerical experiments. Chem. Eng. Sci. 2021, 247, 117005. [CrossRef]
35. Donnelly, R.F.; Mooney, K.; Mccrudden, M.T.; Vicente-Pérez, E.M.; Belaid, L.; González-Vázquez, P.; Mcelnay, J.C.; Woolfson, A.D. Hydrogel-Forming Microneedles Increase in Volume During Swelling in Skin, but Skin Barrier Function Recovery is Unaffected. J. Pharm. Sci. 2014, 103, 1478–1486. [CrossRef]
36. Wang, Z.; Luan,J.; Seth, A.; Liu, L.; You, M.; Gupta, P.; Rathi, P.; Wang, Y.; Cao, S.; Jiang, Q.; et al. Microneedle patch for the ultrasensitive quantiication of protein biomarkers in interstitial luid. Nat. Biomed. Eng. 2021, 5, 64–76. [CrossRef]
37. Shen, D.; Yu, H.; Wang, L.; Chen, X.; Feng,J.; Li, C.; Xiong, W.; Zhang, Q. Glucose-responsive hydrogel-based microneedles containing phenylborate ester bonds and N-isopropylacrylamide moieties and their transdermal drug delivery properties. Eur. Polym. J. 2021, 148, 110348. [CrossRef]
38. Joel, S.; Turner, K.B.; Daunert, S. Glucose Recognition Proteins for Glucose Sensing at Physiological Concentrations and Temperatures. ACS Chem. Biol. 2014, 9, 1595–1602. [CrossRef]
39. Saravanakumar, G.; Kim,J.; Kim, W.J. Reactive-Oxygen-Species-Responsive Drug Delivery Systems: Promises and Challenges. Adv. Sci. 2016, 4, 1600124. [CrossRef]
40. Hsu, W.L.; Huang, C.Y.; Hsu, Y.P.; Hwang, T.L.; Chang, S.H.; Wang, H.Y.J.; Feng, L.Y.; Tzou, S.-J.; Wei, K.-C.; Yang, H.W. On-skin glu-cose-biosensing and on-demand insulin-zinc hexamers delivery using microneedles for syringe-free diabetes management. Chem. Eng. J. 2020, 398, 125536. [CrossRef]
41. Odinotski, S.; Dhingra, K.; GhavamiNejad, A.; Zheng, H.; GhavamiNejad, P.; Gaouda, H.; Mohammadrezaei, D.; Poudineh, M. A Conductive Hydrogel-Based Microneedle Platform for Real-Time pH Measurement in Live Animals. Small 2022, 18, 2200201. [CrossRef] [PubMed]
42. Ogundele, M.; Okafor, H.K. Transdermal drug delivery: Microneedles, their fabrication and current trends in de-livery methods. J. Pharm. Res. Int. 2017, 18, 1–14. [CrossRef]
43. Dabbagh, S.R.; Sarabi, M.R.; Rahbarghazi, R.; Sokullu, E.; Yetisen, A.K.; Tasoglu, S. 3D-printed microneedles in biomedical applications. iScience 2020, 24, 102012. [CrossRef] [PubMed]
44. Park, B.J.; Choi, H.J.; Moon, S.J.; Kim, S.J.; Bajracharya, R.; Min,J.Y.; Han, H.-K. Pharmaceutical applications of 3D printing technology: Current understanding and future perspectives. J. Pharm. Investig. 2019, 49, 575–585. [CrossRef]
45. Economidou, S.N.; Lamprou, D.A.; Douroumis, D. 3D printing applications for transdermal drug delivery. Int. J. Pharm. 2018, 544, 415–424. [CrossRef]
46. Han, D.; Morde, R.S.; Mariani, S.; La Mattina, A.A.; Vignali, E.; Yang, C.; Barillaro, G.; Lee, H. 4D Printing of a Bioinspired Microneedle Array with Backward-Facing Barbs for Enhanced Tissue Adhesion. Adv. Funct. Mater. 2020, 30, 1909197. [CrossRef]
47. Pere, C.P.P.; Economidou, S.N.; Lall, G.; Ziraud, C.; Boateng,J.S.; Alexander, B.D.; Lamprou, D.A.; Douroumis, D. 3D printed microneedles for insulin skin delivery. Int. J. Pharm. 2018, 544, 425–432. [CrossRef]
48. Hanna, K.; Yasar-Inceoglu, O.; Yasar, O. Drug Delivered Poly(ethylene glycol) Diacrylate (PEGDA) Hydrogels and Their Mechanical Characterization Tests for Tissue Engineering Applications. MRS Adv. 2018, 3, 1697–1702. [CrossRef]
49. Aoyagi,S.; Okuda, K.; Takahashi,T.; Suzuki,M. Effect of Microneedle Cross-Sectional Shape on Puncture Resistance–Investigation of Polygonal and Star-Shaped Cross Sections. J. Robot. Mechatron. 2020, 32, 371–381. [CrossRef]
50. Economidou, S.; Pere, C.P.; Okereke, M.; Douroumis, D. Optimisation of Design and Manufacturing Parameters of 3D Printed Solid Microneedles for Improved Strength, Sharpness, and Drug Delivery. Micromachines 2021, 12, 117. [CrossRef]
51. Ghoneim, M.T.; Nguyen, A.; Dereje, N.; Huang,J.; Moore, G.C.; Murzynowski, P.J.; Dagdeviren, C. Recent progress in electro- chemical pH-sensing materials and conigurations for biomedical applications. Chem. Rev. 2019, 119, 5248–5297. [CrossRef]
52. Yao, W.; Li, D.; Zhao, Y.; Zhan, Z.; Jin, G.; Liang, H.; Yang, R. 3D Printed Multi-Functional Hydrogel Microneedles Based on High-Precision Digital Light Processing. Micromachines 2019, 11, 17. [CrossRef]
53. Kundu, A.; Arnett, P.; Bagde, A.; Azim, N.; Kouagou, E.; Singh, M.; Rajaraman, S. DLP 3D printed “intelligent” microneedle array (iμNA) for stimuli responsive release of drugs and its in vitro and ex vivo characterization. J. Microelectromech. Syst. 2020, 29, 685–691. [CrossRef]
54. Lim, S.H.; Kathuria, H.; Amir, M.H.B.; Zhang, X.; Duong, H.T.; Ho, P.C.L.; Kang, L. High resolution photo-polymer for 3D printing of personalised microneedle for transdermal delivery of anti-wrinkle small peptide. J. Control. Release 2021, 329, 907–918. [CrossRef]
相关产品
全部评论(0条)
推荐阅读
-
- 【客户焦点】3D生物打印水凝胶模型:革新听力评估技术
- 利用3D生物打印水凝胶模型推动人工耳蜗评估
-
- 【客户焦点】3D生物打印水凝胶模型:革新听力评估技术
- 利用3D生物打印水凝胶模型推动人工耳蜗评估
-
- 3D生物打印技术如何用于癌症研究?
- 3D生物打印在癌症研究中有巨大潜力,它能创建精确的肿瘤模型,帮助研究人员更好地…
-
- 3D 打印超软强粘附 PEDOT:PSS 水凝胶:生物电子学的创新之选
- 3D 打印超软强粘附 PEDOT:PSS 水凝胶:生物电子学的创新之选
-

- 打印磁性PAAm-SAlg水凝胶
- 磁性水凝胶由于其优异的可控性和响应性,在各个研究领域受到了广泛的关注。哈尔滨工业大学何鹏团队构建了一种基于PAAm-SAlg(聚丙烯酰胺-海藻酸钠)体系的磁性生物相容性水凝胶。
-

- 打印Ti3C2Tx负载水凝胶
- 表面结合配体的界面迁移高度影响半导体纳米晶体的胶体稳定性和光学质量,其潜在机制尚不完全清楚。
-

- 生物医疗领域的超高精度3D打印模具需求 涵盖微流控芯片 微针 仿生器件等
- 从可穿戴和植入式智能传感器到生物芯片,从医疗设备到量子计算机,微纳加工一直是工程前沿,其为制造、材料、能源、机器人和生物医学创造了新的可能性。
-
- 3D打印Ti3C2T x -PAA凝胶
- 具备可拉伸性、粘附性和导电性的水凝胶被认为是与人体无缝和生物相容性结合的理想界面材料。 然而,现有的水凝胶很少能同时具备良好的机械、电学和粘合性能,而且有限的图案化制造技术对生物电子研究及其实际应用。
-
- 深入探索微流体与3D生物打印的奇妙世界!
- 微流控与生物打印是天造地设的生物学伴侣,微流体和3D生物打印标志着生物技术领域的一个激动人心的前沿。
①本文由仪器网入驻的作者或注册的会员撰写并发布,观点仅代表作者本人,不代表仪器网立场。若内容侵犯到您的合法权益,请及时告诉,我们立即通知作者,并马上删除。
②凡本网注明"来源:仪器网"的所有作品,版权均属于仪器网,转载时须经本网同意,并请注明仪器网(www.yiqi.com)。
③本网转载并注明来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
④若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi





















参与评论
登录后参与评论