-
公司新闻
-
4月制药行业专家经验分享回顾以及现场问答总结 | 加速产品无菌检测与放行——快速无菌检测法规更新与中外实践
发布:梅里埃诊断产品(上海)有限公司浏览次数:1190
导读
4月28日晚八点,梅里埃工业技术ZX行业技术专家(健康护理行业) 赵思扬老师做客医麦课堂:从当前传统无菌检测出发,就传统方法的不足引申出快速检测方法,并系统梳理了中外法规的相关章节,实践分析,展示了快速无菌检测方法如何助力企业加速产品无菌检测与放行。
01 无菌检查法
无菌检查是用于检查药典要求无菌的药品、生物制品、YL器具、原料辅料及其他品种是否无菌的方法。生物制品,作为药典要求的无菌药品之一,必须在放行之前完成无菌检查。
•在分享中,赵老师介绍了近年来药典中无菌检查法暴露出的局限性,主要体现为:
•培养基的种类、培养温度和培养时间的选定是折中妥协的结果,并非所有微生物都能在此条件下良好的生长(有超过30%无菌检查失败发生在第7-14天);
•部分生物制品(如疫苗)会引起培养基变浑浊,从而影响判读,故必须进行转种;
•检测并记录培养基的浑浊、絮状菌膜形成和沉淀积累,完全依赖操作者主观判读;;
•14天的培养时间无法满足药品效期的需求。
02 各地区短效期产品无菌检查法规
美国检查法规
21 CFR 211.165章节提到供应产品的测试与放行:“当放射性药物等短效期产品施行无菌或热原检查时,该批次可能需在测试完成前放行,因此需尽快完成。”
USP已施行针对CSPs、PET造影剂、细胞和基因疗法产品等的<1071>.Rapid Microbial Tests for Release of Sterile Short-life Products: A Risk-basedApproach章节。
欧洲检查法规
EP9.2版本(2017年7月)中更新了2.6.27 Microbiological Examinationof Cell-based Preparations章节,考虑到产品的输注效期、本体构成和药品接种量,引入了基于生长的自动化方法,这一法规的改动是配合FDA所批准的两例CAR-T产品进入欧洲市场。
03 替代方法验证
现阶段替代方法的应用需要经过验证后进行报批。
现行《ZG药典》四部9201章节为所采用的试验方法能否替代药典规定的方法提供指导。如果出于成本、生产量、快速简便、提高质量等需要,检验方法不是药典或标准中规定的方法,使用前应进行替代方法的验证,确认其应用效果优于或等同于药典方法。
04 下面是USP和EP中收录的两个代表性方法
USP收载的固相细胞计数法:
•适用于可过滤的样品检测
•荧光酶活标记技术可协助区分出活的微生物细胞
•可在约3.5h内获得结果
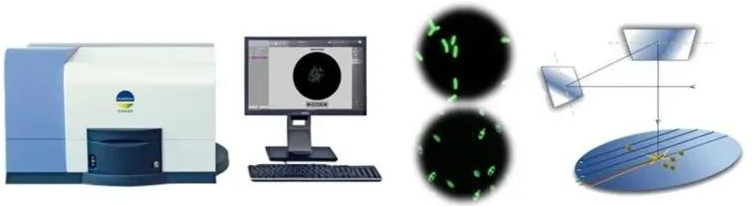
USP/EP收载的呼吸法:
适用于不可过滤的样品检测
微生物代谢中产生的CO2检测,无需依赖培养基浑浊的判读
可在7天内获得结果(用户可基于风险自行验证)

05 直播互动回顾
Q:赵老师,快检的方法如果申报的话,申报老师会认可这个方法吗?
A:只要具备完善的验证资料,检方会按照实际数据进行审核认可的,目前我国也有先例。
Q:赵老师,请问耐用性里温度的改变是指仪器孵育温度的微调还是指对设备所处环境温度进行变更?
A:其实法规只是要求刻意改变条件,如果是基于生长的方法的话温度是有意义的,微调设备温度相对比室温传导更可控一些,其他原理则会有其他相应的参数。
Q:赵老师,方法学验证的话Z少需要多少批次的数据才算是比较合理的,才是申报老师认可的数据?
A:不同的统计学指标评定合理的标准是不同的,以重现性为例,三个批次试剂采集的数据一般是符合实操常规的。
Q:100cfu每单位是每ml吗?
A:如果是指检测限的话,为了体现各原理的可比性,一般液态样本是以/mL为衡量的。
Q:客户现在用的是传统的检测方法,是马上替换成快检吗,这个里面怎么过渡?
A:关于替换进度没有硬性的规定,用户按照自身需求把握验证的进度,如果验证不充分是拿不到批件认可的。
Q:赵老师,有限的取样量无法满足对批产品的无菌保证水平进行科学评价的统计学要求,这个问题赵老师怎么理解?
A:SAL本身是灭菌工艺来满足的而非通过检验手段,而目前法规承认AMM是基于风险的放行,如果课程中讲到的一定是有利弊权衡。
Q:选用快速检测方法选用的培养基还是TSB和FTM吗?滤筒还是选用原来的吗?
A:替代方法指的是和药典中不同的方法,因此不拘泥于滤筒,培养基各系统略有不同。
Q:无菌快速检查方法中,如何有效区分不可培养的微生物,指定的培养基和条件适不适合这些微生物生长?
A:这一问题要看选用的替代方法具体是什么,如果是基于生长的方法学答案是不能区分,但也有很多方法是非基于生长的,这样对VBNC就有可能识别。
Q:新版药典把快检纳入标准了吗?
A:只要具备完善的验证资这一问题要看选用的替代方法具体是什么,如果是基于生长的方法学答案是不能区分,但也有很多方法是非基于生长的,这样对VBNC就有可能识别。
Q:新版药典把快检纳入标准了吗?
A:USP中2019年12月有新的章节生效,EP是部分剂型选入了新的方法,目前ZG药典尚无动作因此仍需参照9201。
Q:对于快速检测方法,取样量与上样量还是参考ZG药典1101吗?
A:不是了,很多的操作细节还需要参照系统的SOP来确定,PQ的过程也可进行充分的摸索。
Q:赵老师,普通无菌样品大多是大体积的薄膜过滤法,目前的快检系统大多是基于直接法,是否对大体积的样品有好的快检建议?
A:也有基于过滤的方法的,六类方法当中ATP法、固相法都有过滤样品的解决方案。
Q:赵老师,ATP和固相法都是固体培养基支持培养吧,没法做到像直接培养法那样封闭原位检测?
A:不是的,这两个方法都有系统是前期滤膜过滤。
Q:赵老师,基于固相技术的快检设备,3.5小时是指全部检测时间?不需要培养吗?
A:目前来说,USP选择的固相代表系统是原位扫描细胞体的,不需要培养,只需有一个激活的步骤。
Q:赵老师,核酸扩增法有推荐的具体的选择吗?
A:PCR方法相对来说比较通用,具体的应用更多的是在通用平台中用户自行开发,因此USP专委会没有给出具体的型号,可以理解为“很多”。
2020-05-14 -
免责声明
①本网刊载上述内容,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任
②若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi







