专注单细胞力学!中空原子力探针设计,更高效的单细胞力谱解决方案
技术简介
单细胞力谱在生命科学、细胞生物学研究中起着至关重要的作用。细胞的力学特性直接反映了细胞的生理状态,高通量测量单细胞的力学特征在疾病的诊断和治 疗中具有广泛的应用前景。然而传统手段却有着诸多局限[1],这主要原因是缺乏一种能够简单、高效抓取细胞并进行力学测定的手段[2]。多功能单细胞显微操作FluidFM技术的出现给单细胞力学的研究带来了新的希望。该技术结合了原子力显微成像技术与微流控技术,能够通过中空的原子力探针将微球或细胞轻松进行抓取,进而通过细胞与细胞、细胞与基质、微球与细胞等相互作用的方式,进行nN到μN级别的细胞水平的力的测量。
FluidFM技术源自瑞士ETH,一经问世就彻底改变了单细胞水平科学研究的研究方式。目前,FluidFM技术主要有两种解决方案,一是FluidFM OMNIUM一体机系统(单细胞显微操作系统),可以自动、高效的完成单个细胞的注射、提取、分离以及单细胞力谱测定。主要应用于活细胞单细胞测序Live-Seq,活细胞线粒体移植,CRISPR-Cas9基因编辑,细胞系构建等方面;另外一个方案是FluidFM ADD-ON系统(单细胞力谱检测系统),它主要是用于单细胞力谱测定方面,具有操作简单、适用细胞种类多、通量高、力学范围宽等优势。
FluidFM技术给研究者带来了一种高效、低损的方式来抓取细胞的力学测定方案,能够真正意义上的做到 精 准、无损、快速的测量单细胞力谱,帮助研究者寻找细胞力学特征与细胞生长发育、肿瘤细胞转移之间的关系。本文将对使用FluidFM ADD-ON进行单细胞力学研究的应用案例进行总结。

FluidFM ADD-ON单细胞力谱检测系统
01、真核细胞与不同类型基底之间的粘附特性研究
组织工程中仿生和响应界面方面的研究开发是一项具有挑战性的工作。Cell-ECM相互作用可以直接调节细胞粘附,迁移,生长,分化和凋亡,Sankaran等[3]使用FluidFM技术研究了小鼠成肌细胞C2C12单细胞与共价表面、非共价表面整合素受体底物之间的相互作用情况(图1a)。
用FluidFM探针抓取单个C2C12细胞后,控制细胞探针在基底(非共价表面和共价表面)上进行Z轴方向的运动,并记录图2(a)中的力曲线。由力学曲线可以得出反映细胞与基底脱离的几个具体参数,包括粘附力图2(b)、剥离距离图2(c)和总功2(d),这些参数可以定量反映细胞与基底之间的粘附相互作用情况。
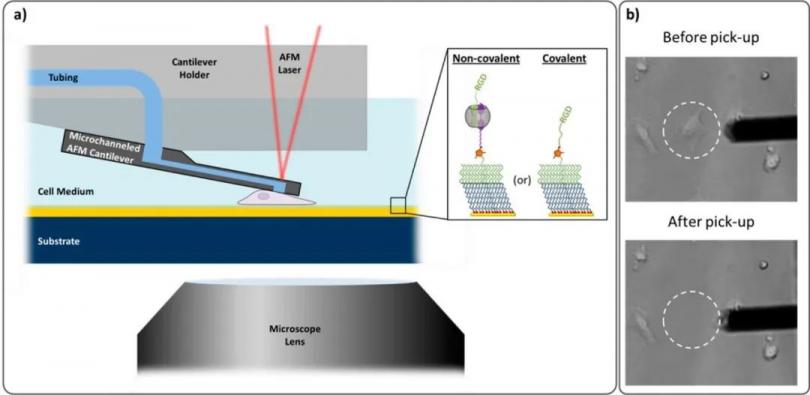
图1 FluidFM技术的原理示意图。图中显示细胞抓取前后的镜下照片。
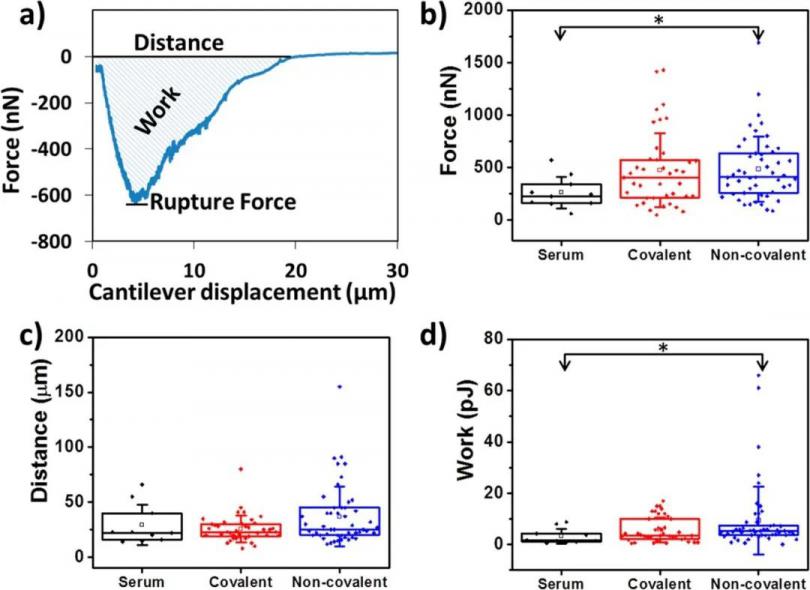
图2 细胞与FluidFM悬臂梁接触后即开始的代表性力-距离曲线。获得粘附力、剥离距离、总功等数据。
本研究利用FluidFM技术简易、高效的完成了单细胞力谱的测定,结果表明,虽然与共价表面相比,生物活性配体在非共价表面上通过相对较弱的力结合在一起,但共价和非共价两种表面的总细胞粘附力非常相近。进一步探究其机理表明,粘附在共价和非共价表面的细胞之间的肌动蛋白丝、局部粘附、粘附力和细胞收缩力等是相近的。
02、真核细胞之间的粘附力测定
细胞在基质上进行单层培养时,吸附在基质表面时主要有两种不同类型的力,一种是细胞与基质之间的粘附力,另一种是细胞与细胞之间的粘附力。因此对于细胞粘附力来说,单个细胞的粘附力就是细胞与基质之间的作用力。而单层细胞的粘附力则是细胞之间相互作用力和细胞基质与细胞之间作用力之和。因而细胞间的相互作用力则可以通过同时测量单层细胞的细胞粘附力和单个细胞的粘附力做差即可得到,如下公式所示:
Force cell-cell ≌ Force Monolayer – Force Indiv.cell
为了能够测量粘附力Sancho等[4]使用FluidFM 技术,将探针靠近细胞至探针与细胞接触,之后开始对探针腔内增加负压从而牢固的吸住细胞。当细胞被抓取后通过仪器位移台的移动抬高探针并记录过程中的力学变化,如下图所示:
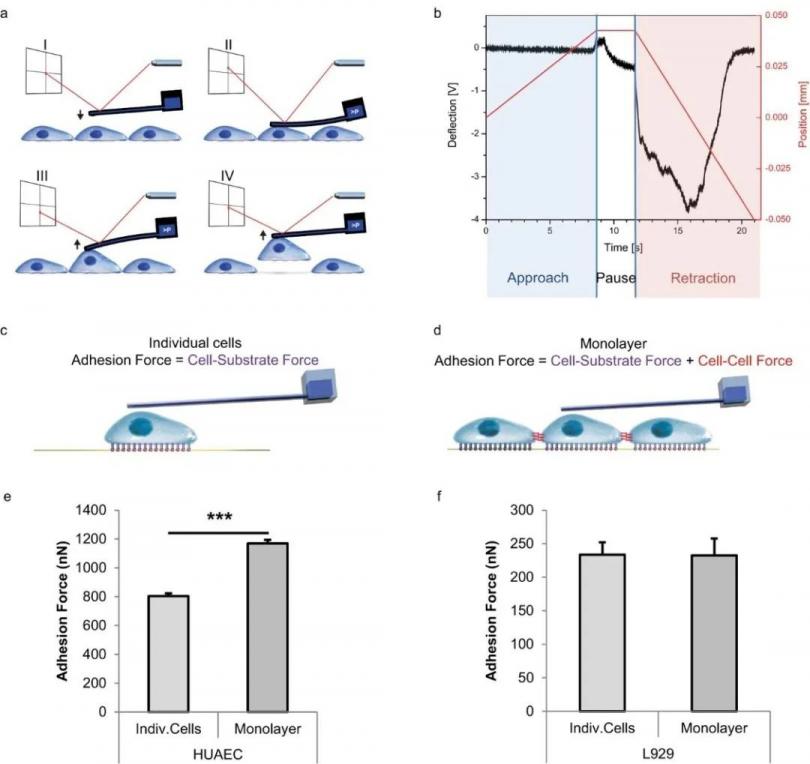
图3 FluidFM对单个细胞及细胞层粘附力测量的示意图及细胞粘附力柱状图。
从图中显示出当探针开始靠近细胞后,探针表面开始出现压力变化,如(图3b)中的蓝色区域所示。当出现这种变化后就停止下降探针并开始施加负压。这时候由于腔内负压,探针和细胞之间的结合变得紧密,导致探针被细胞向下拉动,从而产生了(图3b)中白色区域的力学变化。随后随着探针上升,细胞给以探针的拉力随之增 高,并逐渐达到临界,使得细胞脱离基质。这一过程的峰值即为细胞粘附力。
通过FluidFM技术,作者发现,单层的L929成纤维细胞表现出的细胞与细胞间的粘附力可以忽略不计,而来自HUVEC的细胞在每个细胞中都发挥着强大的细胞间粘附力。
03、杨氏模量Young’s Modulus
内皮细胞-间充质转化(Endothelial-to-Mesenchymal Transition, EndMT)可以引起血管重塑,Sancho等[4]使用一种基于MSX1 (Muscle Segment Homeobox 1)过表达的体外模型来诱导EndMT,并应用FluidFM技术对EndMT早期单层细胞的力学特性进行了测定。
Sancho通过表观杨氏模量作为细胞刚度的特征参数来描述细胞自身的生物力学特性。测量是通过在FluidFM探针顶端抓取一个微珠,并在细胞的核区域进行小凹陷来完成的(图4d,e)。选用探针的悬臂梁的弹簧常数为0.2 N/m,孔径为4 μm。将直径为10 μm的聚乙二醇包覆聚苯乙烯珠(Micromer #01-54-104, Micromod Partikeltechnologie GmbH, Germany)固定在悬臂的孔径处,将密度为5 μg/mL的小珠添加到含有培养基的培养皿中。通过施加700 mbar的吸压抓取珠子,并校准偏转灵敏度。接下来,将探针移动到装有细胞的盖玻片的培养皿 (图4e)。从悬臂开始,在5 μm的距离上在单层细胞的细胞核上进行压痕。该方法通过仪器内部的位移台以500 nm/s的速度完成,直到达到2 nN的设定值,数据采集频率为2000 Hz。每一个压痕都有2s的停顿和5 μm的收缩距离。在实验过程中,在300 mbar的负压下,微珠被保留在尖 端。采用改进的赫兹模型拟合球形压头的力(nN) -压痕(nm)曲线与球形压痕修正的赫兹模型(图4f,g)拟合计算出表观杨氏模量,其中F为力,E为杨氏模量,R为球形压痕半径,&压痕,v为泊松比,本研究设置为0.5。公式如下:
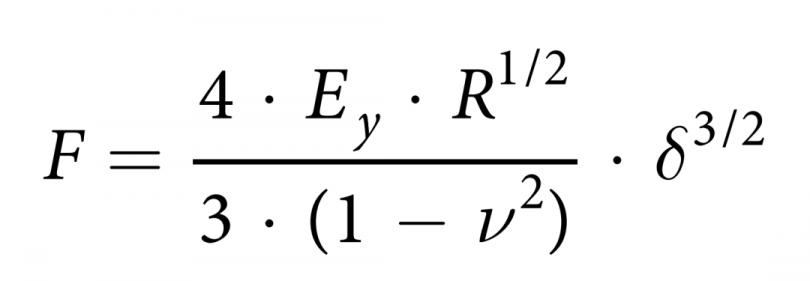
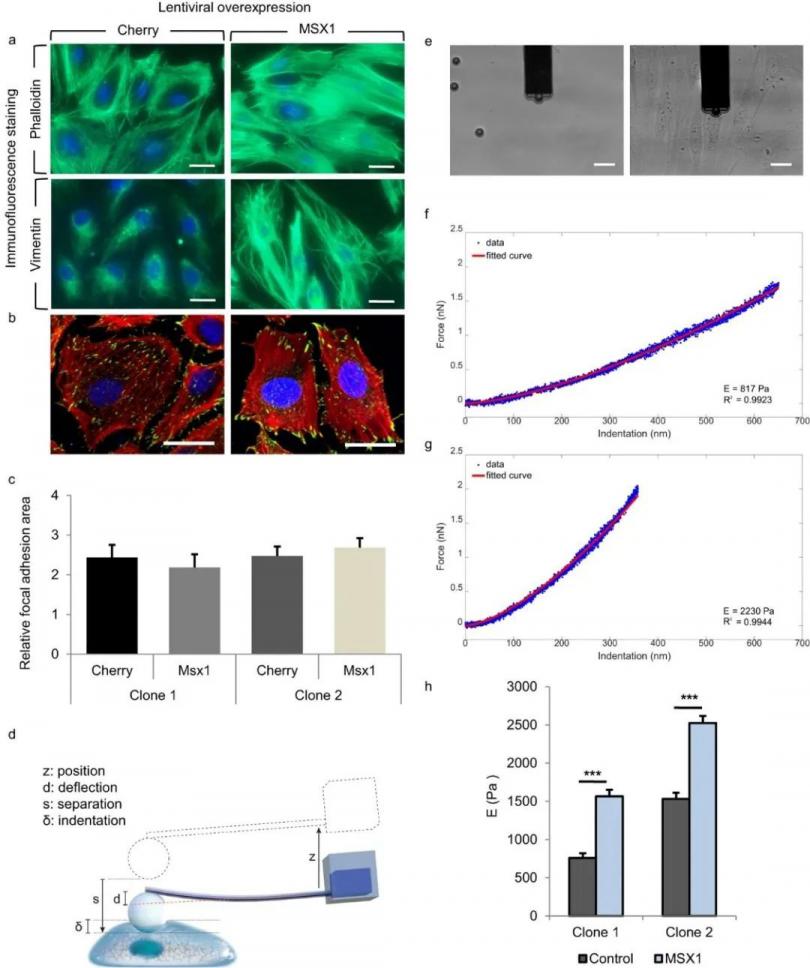
图4 FluidFM 技术杨氏模量检测示意图,MSX1过表达的样本细胞刚度增加。
通过计算表观杨氏模量(Young’s Modulus),作者发现,MSX1过表达细胞的刚度明显大于对照细胞(图4h),其值大约是对照细胞的两倍(克隆1从760 Pa到1530 Pa,克隆2从1565 Pa到2523 Pa)。结果表明,在EndMT过程的早期,HUAECs的弹性特性已经发生变化,导致刚度增加。这些变化与已知的细胞骨架重组相一致,该重组可实现细胞的动态伸长和定向运动。
04、细胞弹性谱图
单个活细胞的力学特性已被证明是细胞生理状态的重要指标。细胞体与细胞外基质(ECM)边界的肌动蛋白皮层(AC, actin cortex)由质膜和肌动蛋白细胞骨架组成,通过丰富的跨膜和适配器蛋白连接在一起。AC的结构和生物力学紧密交织在一起,进而影响分子机械传感器的功能。
基于FluidFM技术的研究数据提供了关于细胞力学特征的丰富信息。Lüchtefeld等[5]在杨氏模量的基础上提出了一个扩展的分析方法,以进一步明确解释肌动蛋白皮层的特性,即弹性谱(Elasticity Spectra),用来计算细胞的胞体表观刚度与压痕深度的函数关系。弹性谱方法在一组细胞骨架影响药物处理的细胞上进行了测试和验证,显示了扩展当前细胞力学表征的潜力。
使用FluidFM进行弹性谱测量的具体实验方案是:选用孔径为2 μm、弹簧常数为0.3 N/m的FluidFM探针进行实验。将探针的孔道中填充含有0.1 mg/ml蓝色荧光染料AMCA(7-氨基-4-甲基香豆素,Sigma-Aldrich, USA)的生理溶液,用于堵塞检测。将直径为3 ~ 4 μm的绿色荧光珠(Phosphorex Inc, USA)放置在融合细胞层旁,通过微探针施加800 mbar的负压压力将其抓取在探针尖 端。压痕以1 μm/s的接近速度和100 nN的力设定值在5 × 5点的网格上进行,间距为25 μm。
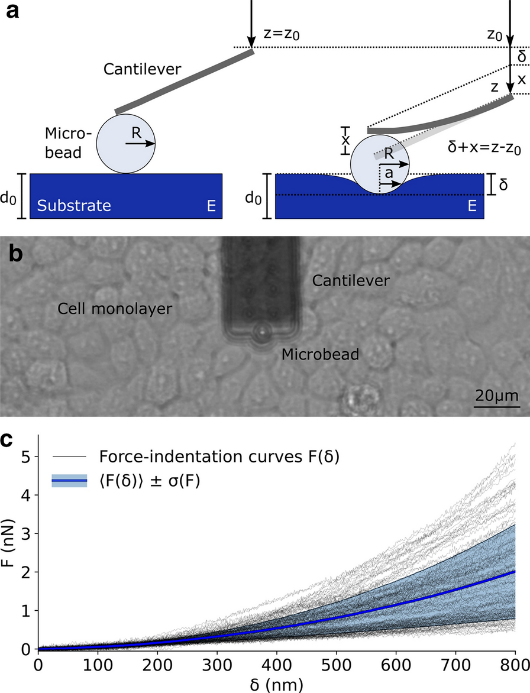
图5 半径为R的球形探针在具有杨氏模量的柔性材料上进行纳米压痕实验示意图。并获得127条细胞力-压痕曲线的典型实验数据集。
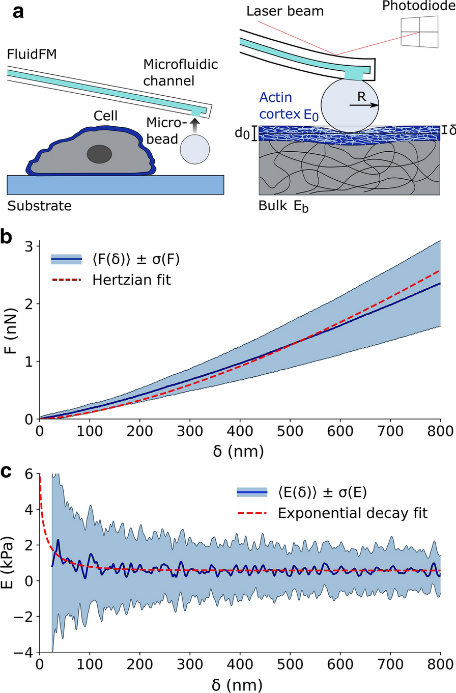
图6 单细胞弹性谱实验方案示意图。并获得 315个细胞的力-压痕曲线数据集。
基于FluidFM技术进行的弹性谱ES的双层模型为更高通量的筛选影响AC力学的药物,评估环境或生理病理条件对AC动力学的,以及研究细胞内力对细胞力学敏感性的影响提供了一个有价值的工具。
05、原核细胞间相互作用力
白色念珠菌在医院的慢性疾病患者中经常形成耐药生物膜。细胞粘附和生物膜的形成涉及细胞表面Als (agglutinin-like sequence)蛋白家族。在机械应力下,Als蛋白的淀粉样簇可以激活细胞粘附。
Dehullu等人[6]使用FluidFM技术对酵母菌Als蛋白的功能进行了研究,具体实验方案是通过仪器系统的负压将一个酵母细胞固定在FluidFM空心探针上,另一个酵母细胞被物理性地阻隔在多孔膜中(图7,A)。用荧光染料染色对酵母细胞的活性和细胞的完整性进行标记(图7,B)。然后,通过FluidFM来记录力学曲线,测量不同条件下酵母细胞之间的相互作用情况,如在改变淀粉样蛋白序列或降低细胞表面的蛋白质密度等。
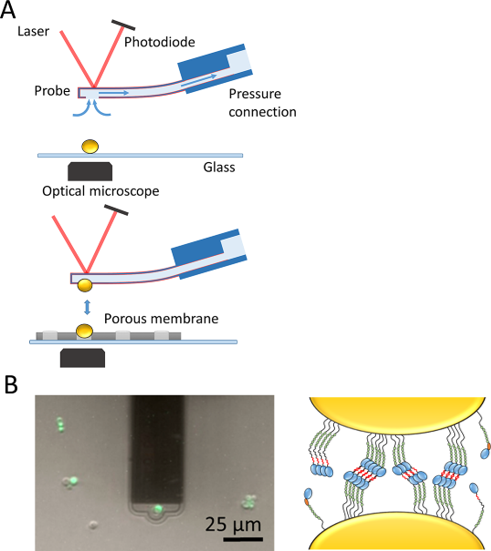
图7 使用FluidFM技术检测酵母-酵母细胞之间的相互作用力。
利用FluidFM技术,可以很容易地通过施加负压力将单个原核细胞固定在FluidFM中空探针上,进而可以测量微生物之间的相互作用力。文章结果表明,Als5蛋白在粘附细胞上的同源性结合是真菌聚集的主要方式。由于在许多微生物黏附素中发现了潜在的淀粉样蛋白形成序列,作者推测这种基于淀粉样蛋白的同源性黏附的新机制可能广泛存在,并可能成为治 疗生物膜相关感染的一个有意义的靶点。
06、微球与固定细菌之间相互作用
Mittelviefhaus[7]等通过FluidFM技术开发并应用了一种通用而高通量的方法来量化不同细菌细胞与基质之间的粘附情况。具体实验方案是:二氧化硅微球通过FluidFM探针的通道负压方便可逆地固定。该微球用于探测与固定在多巴胺涂层玻璃上的细菌的相互作用。通过聚多巴胺涂层将目标细菌固定在玻璃表面,以防止测量过程中细菌的位移(图8a)。将微球与一个单独的细菌接触——这一过程在显微镜的光学成像系统下进行。在达到10 nN后,接触保持5 s,然后收回悬臂并记录力学曲线 (图8b)。
然后再次使用该微球来测量与另一个细菌细胞的粘附力;进而,通过一个短的超压脉冲将第 一个微球放下,然后通过相同的探针可以很容易地抓取另一个新的微球而进行后续的实验。这样便实现了细菌细胞的高通量力学测量。
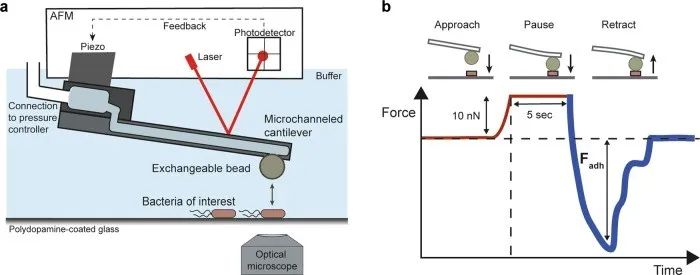
图8 FluidFM技术检测细菌与基质之间的粘附力
研究结果证实了疏水性在细菌起初附着在其自然宿主叶片上的作用情况。细菌粘附是细菌表面定植和群落形成的第 一步。本文使用FluidFM技术可以可逆地固定功能化微球作为表面模拟物,并探测单个细菌的粘附。作者对不同大小和形态的叶片分离物进行了系统发育多样性的单细胞力谱分析。对28株细菌的粘附测定显示,疏水相互作用的差异较大,约为3个数量级。细菌的粘附力可高达50 nN。不同分离株的疏水性与细菌在植物中的滞留量呈正相关,这可能为病原菌成功的叶片定殖和潜在的病害暴发提供依据。
综上所述,细胞水平的力学研究常用的方法是利用包被的AFM探针,目前缺乏一种能够在不改变细胞性质的同时测量细胞整体粘附力的方案。FluidFM 技术的出现改变了这一状况。高精密的中空微流控探针能够在精 准感知压力的同时通过内压而非蛋白结合的方式牢固地抓取细胞而不改变细胞性质,为单细胞力谱的测定打开了全新的局面[8]。
瑞士Cytosurge 推出的全新的FluidFM 技术给单细胞力谱研究带来了全新的解决方案。这种技术结合了原子力显微镜探测技术与精密的微流体控制系统,直接使用中空的原子力探针将细胞通过负压抓取在探针表面,而不需要激活细胞的任何通路信号,为粘附力等细胞层面的力学测量带来了很大的优势。一方面,这种方法能够提供远比蛋白结合牢固多的粘附力,将细胞牢固地固定在探针上面,因此能够直接从基质上分离。而另一方面,由于没有生物处理,这种方法不会改变细胞表面的任何通路,从而能够得到接近细胞原生的数据。
全部评论(0条)
推荐阅读
-

- 专注单细胞力学!中空原子力探针设计,更高效的单细胞力谱解决方案
- 本文将对使用FluidFM ADD-ON进行单细胞力学研究的应用案例进行总结。
-

- 2023第一站:单细胞显微操作系统落户西湖大学!助力单细胞测序等研究高效发展
- 近日,Quantum Design中国公司在西湖大学完成了单细胞显微操作系统FluidFM的安装工作,并对用户进行了相关知识和设备操作的全面培训。
-
- 布鲁克原子力显微技术研讨会---合肥
- 诚挚邀请大家报名8月28号布鲁克原子力显微技术研讨会合肥站!
-
- 高效构建hiPSC系的全自动化神器,单细胞可视化分选培养系统,让单细胞培养不再复杂!
- 高效构建hiPSC系的全自动化神器,单细胞可视化分选培养系统,让单细胞培养不再复杂!
-

- 2023第 一站:单细胞显微操作系统落户西湖大学!助力单细胞测序等研究高效发展
- Quantum Design中国公司在西湖大学完成了单细胞显微操作系统FluidFM的安装工作,并对用户进行了相关知识和设备操作的全面培训
-

- 4月28日网络讲座:原子力轮廓仪的原理及其应用
- 原子力轮廓仪的原理及其应用
①本文由仪器网入驻的作者或注册的会员撰写并发布,观点仅代表作者本人,不代表仪器网立场。若内容侵犯到您的合法权益,请及时告诉,我们立即通知作者,并马上删除。
②凡本网注明"来源:仪器网"的所有作品,版权均属于仪器网,转载时须经本网同意,并请注明仪器网(www.yiqi.com)。
③本网转载并注明来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
④若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi

















参与评论
登录后参与评论