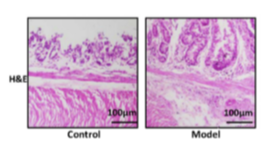
结直肠癌是全球高发恶性肿瘤,其免疫治疗面临严峻瓶颈——pMMR/MSS 亚型患者对免疫检查点抑制剂应答率极低,核心症结在于免疫抑制性肿瘤微环境(TME)的形成。具核梭杆菌(F. nucleatum)作为结直肠癌进展的关键驱动菌,不仅促进肿瘤发生、进展、转移和化疗耐药性,还构建免疫抑制性肿瘤微环境(TME),阻碍 T 细胞介导的应答。针对结直肠癌(尤其 pMMR/MSS 亚型)免疫治疗耐药的临床痛点,创新性开发感染特异性环丙沙星前药纳米颗粒(MTCP-NPs)。该载体通过 “靶向 M2 巨噬细胞 + 胞内菌感染响应释药” 的双重机制,精准清除定植于肿瘤相关巨噬细胞(TAMs)内的具核梭杆菌,同步重塑免疫抑制微环境,联合抗 PD-L1 抗体实现协同增效,为微生物群驱动型肿瘤治疗提供了全新范式。
该研究证实,MTCP-NPs 纳米前药通过 IL4 受体(IL4R)介导的靶向递送与 CTSB 响应性释药的双重机制,能高效靶向 M2 型肿瘤相关巨噬细胞并实现 80% 的摄取率,在具核梭杆菌感染部位精准释放环丙沙星,48 小时内清除 90% 胞内致病菌,远优于传统抗生素与无靶向纳米载体;同时可显著下调 IDO 分泌、减少髓源性抑制细胞浸润及调节性 T 细胞占比,促进树突状细胞成熟与 CD8?T 细胞浸润,成功将 “冷肿瘤” 转化为 “热肿瘤”,有效重塑免疫抑制微环境;体内实验中,该纳米前药在皮下结直肠癌模型中使肿瘤内具核梭杆菌存活率降低 95%,显著延长小鼠中位生存期至 21 天,在原位模型中与抗 PD-L1 抗体联合使用时协同增效,将中位生存期提升至 44 天,且能富集脾脏中央记忆 T 细胞以维持长期抗肿瘤免疫应答;此外,MTCP-NPs 生物相容性优异,溶血率低于 5% 且对正常细胞毒性极低,还可特异性清除致病菌群、富集乳杆菌等有益菌,维持肠道菌群平衡,避免了广谱抗生素对共生菌群的破坏,为 pMMR/MSS 亚型结直肠癌等免疫治疗耐药肿瘤提供了兼具疗效与安全性的新型治疗策略。
文章中,研究团队在评估MTCP-NPs 单独使用以及与抗 PD-L1 免疫检查点抑制剂联合使用的治疗效果时,采用了广州博鹭腾D-荧光素钾盐来检测CT26-Luc细胞在原位CRC中的进展。实验结果显示,与 PBS 相比,抗 PD-L1 单药治疗效果极小,而 MTCP-NPs 单独使用显著抑制了肿瘤生物发光。值得注意的是,MTCP-NPs / 抗 PD-L1 联合治疗显示出协同增强作用,终点分析证实与单药治疗相比,肿瘤重量和转移结节均显著减少。
论文链接:
https://doi.org/10.1016/j.jconrel.2025.114512
全部评论(0条)






①本文由仪器网入驻的作者或注册的会员撰写并发布,观点仅代表作者本人,不代表仪器网立场。若内容侵犯到您的合法权益,请及时告诉,我们立即通知作者,并马上删除。
②凡本网注明"来源:仪器网"的所有作品,版权均属于仪器网,转载时须经本网同意,并请注明仪器网(www.yiqi.com)。
③本网转载并注明来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
④若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi
参与评论
登录后参与评论