-
产品文章
-
前沿进展:通过微生理方法解决药物分子预测难题(二)-1
发布:北京佰司特科技有限责任公司浏览次数:222前沿进展:通过微生理方法解决药物分子预测难题
—第四届大西洋毒理学研讨会报告(二)-1
Biology-inspired Microphysiological System Approaches to Solve the Prediction Dilemma of Substance Testing
t4 Workshop Report-跨大西洋毒理学智库的报告,该智库由Doerenkamp Zbinden基金会赞助,由巴尔的摩、康斯坦茨和乌得勒支的毒理学负责人合作完成。本文所表达的观点是作者本人的观点,不一定代表他们的工作机构的观点。
May 15, 2016
翻译和整理:北京佰司特贸易有限责任公司
最JIN出现的微生理系统——在体外模仿人体组织、器官和循环生物学的微流控仿生装置——被认为是可能彻底改变如今的药物开发模式。一项近期由美国政府倡议并在欧洲和亚洲开展的研究项目,最JIN获得了第Yi个前沿成果:基于微生理系统的人的单器官和多器官工程,在此基础上建立的测试系统有望模拟不同的疾病阶段,并在临床试验之前预测毒性、免疫原性、ADME谱和ZHI疗效果。这一技术将对药物发展的未来产生重大影响。此外,基于微生理系统的分析可能会彻底改变我们当前的模式,对任何新物质(例如用于农业、食品、生态系统或化妆品)的危害进行排序,从而取代目前使用的实验动物模型。来自学术界、工业界和监管机构的36位专家在德国柏林举办了一个集中研讨会(2015年6月),回顾了目前微生理系统的现状,并评估了药物开发周期中广泛的、具有潜力的方法,提出了可行的技术解决方案,以实现人的体外生物学的下一个级别的技术。此外,会议ZHONG点介绍了器官芯片的重要的案例,以及各种国家和国际项目。最HOU,概述了未来的路线图,允许在全 SHIJIE范围内进行更具预测性和监管认可的物质检测的方法。
2. Microphysiological systems – an expanding toolbox for hazard, safety, disease and efficacy prediction of particulate matter, chemicals and drug candidates
微生理系统-用于微粒物、化学品和候选药物的危害、安全、疾病和效能预测的工具箱
2.3 MPS技术的现状
2.3.1 介绍
任何以静态细胞培养为基础的检测技术的缺点包括氧气和营养物质限制在给定的3D组织大小,或单层代谢,以及缺乏动态蛋白质梯度。例如,在静态培养瓶中培养原代人肝细胞时,氧限制早在1968年就被描述过(McLimans等人,1968)。微制造和微流体技术,早在1990年就作为一门科学学科而诞生(Manz等人,1990年),并在20世纪末交付了商业化的单片实验室平台(见El-Ali等人,2006年和Whitesides,2006年的评论),与材料科学相关的生物工程的进展使第一种基于板和芯片的微流控组织培养系统的出现,旨在解决上述静态培养的两个限制,并复制时空,机械和生物化学线索,这些组织内在的生理行为。MPS开发人员从两个不同的角度进行开发,其中一些着眼于将营养供应的微流控原理集成到成熟的工业高通量顺应静态细胞培养微滴度井格式中,一些试图将成熟的工业组织培养生物反应器系统小型化。基于板的MPS开发适应常规静态细胞培养微滴度板阵列96,384和1536孔,已成为任何生物实验室的选择标准。微滴度板提供了额外的优势,因为它们已经被各行业完全接受为标准[SLAS,2014]。这些平台出现的理由是,实验的纯粹性质和生物学固有的可变性需要大量的对照实验、重复和稀释。此外,分子和细胞生物科学的趋势已经发展到更高的通量方法,在一次实验中测试更多的条件。正是由于这些原因,按照本标准设计了手动和自动液体处理和读数设备。此外,平板中孔的数量较多,如384孔、1536孔甚至是3456孔,提供了减少细胞和试剂体积的额外优势,导致每次检测成本的降低。用于组织和器官建模的基于芯片的微生理系统通常是在传统工业细胞培养生物反应器的基础上进行了改进,试图缩小流体和组织培养室的规模,并缩小所需的传感器和驱动器。20世纪70年代早期发明的自动化动态生物反应器,如中空纤维生物反应器,通过引入人工毛细血管进行介质灌注,大规模解决了氧气和营养供应的问题(可达1L组织培养)(Knazek,1972)。这些动态灌注组织培养系统后来发展成为具有长期功能的体外器官等效物,在20世纪90年代末作为体外生物人工肝装置引入医疗实践(CatapanoandGerlach,2007;Gerlach,1996;Wang等人,2010)。基于这一历史知识,许多动态的组织特异性生物反应器设备,如用于免疫原性测试的人类人工淋巴结,被缩小,用于体外测试,以降低每个组织培养规模的mL(Giese等人,2006)。图5展示了一个微型的依赖培养箱的动态生物反应器原型,用于同时培养0.5ml的人体免疫组织。不幸的是,在本世纪的第一个十年中,很明显,较低的mL规模仍然需要太多的细胞供应,而且仍然太大,无法以合理的成本同时进行高含量测试。这引发了基于芯片的MPS的出现,它采用了芯片上的实验室平台来减少组织培养体积,从微到纳米级的每个组织培养室。他们的目标是应用自动化泵送系统和电气、光学和机械转导来监测和控制在自动化培养箱独立系统中相关产量的复杂微小组织培养。

图5:中空纤维灌注的单器官微型盒式生物反应器装置。 集成机电控制的蠕动泵(A),10个微控制器(B)。在恒温箱中运行的微生物反应器用于温度、湿度和CO2控制(C)。(由ProBioGen AG,德国提供)
总之,基于平板和芯片的MPS目前旨在反映生理相关参数,包括适当的细胞-细胞、细胞-基质、生化和机械信号。这些能力提供了前所未有的机会来创造微生理系统,这些微生理系统具有捕捉人体疾病外观、修复和再生过程以及药物作用的动态的潜力。微生理系统发展的最XIN进展使细胞环境和/或肺、心脏、血管、肌肉、骨骼、肝脏、生殖系统、神经系统(包括眼睛)、肠道、皮肤、肠道和肾脏的功能单元的工程成为可能。在本章中,我们报告了受生物学启发的单器官和多器官微生理系统的发展现状及其在物质检测中的应用。此外,我们还介绍了利用MPS建模疾病的研究成果。第4章概述了将多器官系统推进到人体芯片解决方案的最XIN举措。
2.3.2单器官微生理系统的研究现状
CellAsic(Leeetal.,2007a)开发了早期微滴度板微流体细胞培养格式,采用被动重力微流体流方法进行体外组织再生,并应用于人类疾病建模和药物开发。受LukeLee小组工作的启发(Leeetal.,2007b;Hungetal.,2005b),他们开发了一种微滴度板,有8个独立的流动单元,不需要管道进行灌注流,而是依赖于被动水平。该设备由粘接在玻璃底部的聚二甲基硅氧烷(PDMS)模压微流控层和丙烯酸用户界面组成。在真空歧管的帮助下,细胞被引入,并通过由密集填充的微柱组成的过滤器定位。灌注流是由重力水平结合精心调节的微流体通道的流体阻力诱导的。
PMedizintechnikgmbh(oberschleis.comheim,Germany)智能微标仪是一种基于24孔的先进微生理系统,包括自动显微镜、移液机器人和pH、溶解氧和阻抗的微传感器,并预先安装在培养箱中(Demmeletal.,2015)。它被成功地用于监测各种细胞类型和原代组织的活力(Kleinhansetal.,2012)和开发新的毒理学终点(Wolfetal.,2011)。相对较高的并行度和移液机器人和显微镜的自动化程度使得MPS领域的自主、无标签的长期实验成为可能。然而,所使用的PDMS材料具有将候选药物与该装置高度非特异性结合的潜力。美国威斯康星大学麦迪逊分校的DaveBeebe团队开发了一系列基于微滴度板的细胞培养设备,包括3D培养板和趋化板(Berthieretal.,2010)。微滴度板上共有192个单通道被载细胞凝胶填充(Meyvantssonetal.,2008)。利用不同大小的液滴在入口和出口处的差半月板压力,在凝胶间进行了间隙流。类似的泵浦概念被用于49通道网络趋化装置,由一个源通道和一个汇通道连接到一个非常薄的梯度通道。荷兰MIMETAS公司最JIN推出了OrganoPlate,由40到96个单独可定位的微流网络组成(Jang等人,2015;Moreno等人,2015;Trietschetal.,2013)。OrganoPlate利用PhaseGuide技术将细胞外基质(ECM)凝胶有序分层,一层接一层。这使得一种完全不需要人工膜的共培养方法成为可能,同时仍然能够进行组织工程。有机板完全没有高吸光度物质,如PDMS,不需要任何其他操作设备,除了标准移液器,并通过被动流平提供连续灌注流。
麻省理工学院(Cambridge,USA)的LindaGriffith小组将基于平板的微流体细胞培养模式引入肝脏模型,并由CNBioInnovations(London,UK)商业化。Liverchip™系统是一种基于平板的系统,下面将详细描述。在过去的十年中,一波单器官芯片的概念被提出,涵盖了广泛的组织,并被积极地引入生物学研究。他们从不同器官特异性的单细胞类型培养开始,如内皮细胞(YoungandSimmons,2010)、成肌细胞(Guetal.,2004)、肝细胞(Carraroetal.,2008;Goraletal.,2010;Hoetal.,2006;Leclerc等人,2004年;李等人,2007b;Park等人,2008;鲍尔斯等人,2002年;Toh等人,2007;Tohetal.,2009)、神经元(Rheeetal.,2005)、乳腺上皮细胞(Graftonetal.,2011)、脂肪细胞(Nakayamaetal.,2008)和人类胚胎细胞(Chungetal.,2005;洪在al.,2005a;Smith等人,2012;Villa-Diaz等人,2009)。因此,在下一阶段,异型微流控单器官共培养系统将特定器官的关键细胞类型结合到人工功能单元中,更真实地反映了单个器官的各个方面。在过去五年中,器官芯片模型领域的科学活动急剧增加(vandeStolpeetal.,2013)。因此,我们决定以典型的方式强调用于人类肝脏和肺建模的单器官MPS开发,同时让读者参考其他器官和系统的原始MPS文献。基于mps的肝脏培养已经从动态随机细胞培养成熟到组织复杂度更高的系统。肝脏对机体稳态(如血浆蛋白合成、葡萄糖生物转化)和血液解DU(如尿素、外源性药物代谢)具有独特的重要性,这导致了人类肝脏结构在其最XIAO功能单位——肝小叶的规模上的进化优化。沿着500μm长的约25个以绳状排列的肝细胞进行精确的分区分工,使血液接触时间仅为几秒钟即可进行血液解DU。血浆与肝细胞接触的流体动力学知之甚少。在Disse空间的等离子体流动的性质和应用于这些基底外侧表面的肝细胞的力学是有争议的。开窗程度高可能导致流体剪切应力传递到肝细胞。此外,门静脉周围区的窦道直径很小,只有红细胞大小。血细胞通过这些紧密的窦道时还可能调节切应力。到目前为止,已有四种基于mps的肝脏等效物:随机动态肝细胞单培养、索状肝等效物、内皮窦模型和肝小叶“等效物”(Materneetal.,2015)。图6突出显示了后三种类型的示例。
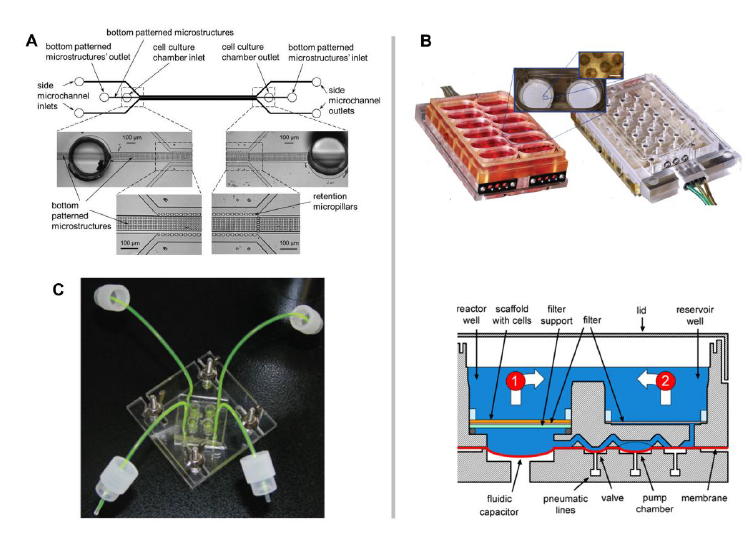
图6:受生物学启发,mps肝模型的复杂性不断增加。MPS从胆管形成的索状肝培养(A),到支持功能空间Disse结构的窦状排列(B),再到维持功能器官状肝结构的组织切片培养(C)。
与随机动态肝细胞培养相反,Goral和同事(2010)提出了由极化细胞组成的三维索状结构,形成延伸的胆管结构。一系列保留柱在两个侧通道之间形成一个微通道(图6a)。然而,与其他基于灌注的微设备不同,细胞培养室底部的微结构提供了额外的肝细胞极性控制。灌注培养两周后,细胞仍能存活并形成索状结构。可以看到胆管结构的延伸和三维结构细胞之间缝隙连接的形成。上述系统允许肝细胞排列成人工的、但类似于索状的集合,恢复肝细胞极性并支持零星的胆汁分离。肝细胞与非实质细胞在持续灌注的三维空间环境中共培养,可能会形成与体内情况下下一个层次的结构相似。LindaGriffith的团队在麻省理工学院(Domanskyetal.,2010)开发了一种非常有趣的方法来建模微流控系统中的类正弦结构。多个生物反应器阵列构建在由12个自主微流控系统(图6b)组成的多孔板中,每个孔板由集成的气动微泵灌注,循环总容积为3ml。每个组织培养支架包含769个多通道(0.24mm深,106个大鼠肝细胞与内皮细胞按1:1的比例接种。连续可调的氧气梯度可以建立在长时间的操作时间。支架支持接近生理组织密度和肝细胞功能分区可以规定。支架的大通道支持两种细胞类型在动态条件下的自组装。肝窦内皮细胞在体外已失去分化表型,但在整个培养过程中仍保持功能标记物SE-1的表达。基于氧气消耗模型的可调流量、长期稳定的梯度维持以及肝细胞与不同类型的非实质细胞共培养的能力等重要特性使该系统成为一种有趣的毒性测试方法。这是研究中的多磺酸粘多糖随后得到改进并转化为工业应用的罕见案例之一。由CNBioInnovations商业化的这个LiverChip™系统的支架尺寸可以缩放到10,000-1,000,000个细胞,而平板同样缩放到12孔或36孔格式。主动泵送提供循环,使流经组织的流速与组织的形态分离。该系统为药物代谢和药代动力学、毒理学和疾病生物学应用提供高含量数据(Sarkaretal.,2015;Vivares等人,2015)。它已应用于临床前开发(Dash等,2009;Vivares等人,2015)。此外,在该平台上建立了肝癌细胞微转移模型,并在该模型中建立了侵略性MDA-MB-231细胞系休眠的证明(Wheeleretal.,2014)。使用相同的三维灌注肝脏模型也建立了乙肝病毒感染模型。低温保存的原代人肝细胞通过与病人血清孵育而感染。概述了病毒的整个生命周期,使该模型在探索乙型肝炎病毒的基础生物学和评估新的治ZHI疗方法方面发挥效用(Waietal.,2014)。
建筑的最GAO水平-整个肝小叶尚未达成,但是芯片微流控方法包含的主要部分已由肝小叶vanMidwoud和他的同事们(van Midwoudetal.,2010),培养3毫克的肝脏切片组织的微流控芯片(图6c)。精密切割的肝切片(厚100μm,直径4mm)在恒定pH和溶解氧的培养箱中以10μl/min的流量灌注。在静态培养3小时以上的对照切片中,生物转化活性是相等的。在三个小时的测量时间内,该系统在代谢功能方面没有显示出任何优势。作者强调了在低组织-液体体积比下连续介质灌注的优势,相对于静态培养中稳定的代谢物积累。不幸的是,目前还没有关于超过72小时的培养表现的数据(vanMidwoudetal.,2011a)。
除了上述例子,基于mps的单器官肝脏建模已经导致了大量的芯片肝脏设备(Baudoinetal.,2014a;Hwaetal.,2007;凯恩等人,2006年;Khetani和Bhatia,2008;Leclerc等人,2014;Leclerc等人,2015;Legendreetal.,2013;Legendreetal.,2014;Pasirayi等人,2014;研究工具和分析已经开发出来,用于研究单器官芯片的肝脏代谢和毒性(Baudoinetal.,2014b;Leclerc等人,2014;Leclerc等人,2015;Legendreetal.,2013;Legendreetal.,2014;Pasirayi等人,2014;Snouber等人,2013a)。关于芯片上肝脏模型阅读器开发的更多细节,请参阅各自的综述(Materneetal.,2013;vanMidwoud等人,2011b)。

图7:应用机械拉伸的仿生微流控肺泡模型。(A)本机和拉伸状态下的设备横截面图。 膜的顶部培养人肺泡上皮细胞,膜的底部培养人肺微血管内皮细胞。 (B)肺视图,显示吸气时空气的伸展和由此产生的分布。 通过侧腔施加循环真空使细胞层拉伸,模拟吸气时的自然拉伸。 转载自Huh等人(2010)。
另一个复杂的器官是人类肺,受生物学启发的mps模型已经在理解人体器官功能、测试安全性和建模疾病方面发挥了作用。人类小气道和肺泡的体外模型是在细胞培养插入物上静态气液界面培养的历史。对于这些模型的全面概述,读者可以参考Gordon及其同事最近的t4报告(2015)。直到最近,只有少数试图模拟肺功能部分的MPS被开发出来(Nalayandaetal.,2007;Nalayandaetal.,2010),但是在2010年,由美国马萨诸塞州波士顿哈佛大学Wyss生物启发工程研究所的DonaldIngber小组开发的微生理芯片肺系统首次登上了《科学杂志》(Huhetal.,2010)。图7a显示了这个模拟肺泡功能的系统的设计和原理。该系统是通过微制造两个微通道的腔室来制备的,两个微通道之间由涂覆纤维连接蛋白或胶原蛋白的薄(10μm)多孔PDMS膜隔开。膜上培养人肺泡上皮细胞(上通道),膜下培养人肺微血管内皮细胞(下通道)。空气通过顶部通道泵入,培养液作为血液的替代品通过下部通道泵入。因此,该系统是模拟肺泡-毛细血管屏障。通过在侧通道上施加真空,可以拉伸培养层;真空的释放引起薄膜的弹性反冲,使其回到自然状态,模拟呼吸时肺泡的拉伸(图7b)。空气中的分子通过被动扩散和主动运输的结合穿过培养液层,如肺中的肺泡。Huh和他的同事(2012)使用他们的芯片肺系统开发了一个肺水肿模型。肺水肿是一种危及生命的疾病,与各种疾病或剂量限制药物毒性引起的静压或微血管通透性增加有关(Willett,2014)。Huh和他的同事(2012)证实,给高剂量的白介素-2(IL-2)在他们的芯片肺系统中引起了一种与肺水肿一致的状态,类似于给人类癌症患者使用IL-2的效果。他们还发现,血管生成素-1和GSK2193874(一种瞬态受体电位香草醛离子通道抑制剂)可在体外减轻水肿,并可能在临床环境中阻止IL-2的这种剂量限制毒性。作者得出结论,该系统可以用于其他器官的疾病模型,并预测其他药物在人类中的疗效和毒性。仿真公司(波士顿,美国)正在将基于该平台的工具商业化。该系统还被用于检测细胞内活性氧(ROS)对纳米颗粒的反应(Huh,2015;Huhetal.,2010)。
在这些研究中,直径为12纳米的二氧化硅纳米颗粒诱导并放大了根据活性氧生成测量的急性毒性反应。循环拉伸和松弛多孔膜以模拟呼吸,进一步增强了二氧化硅纳米颗粒从上层空气通道到下层流体通道的吸收和转运。在小鼠全肺通气灌注模型中也观察到类似的结果。
其他研究小组已经开发了一种芯片肺系统,使用的是来自接受部分肺切除术(Stuckietal.,2015)患者的人原发性肺泡上皮细胞或原发性气道上皮细胞(Boletal.,2014;Sellgrenetal.,2014)用于选择治疗肺部病变的候选药物。最后,在芯片小气道模型的基础上建立了化疗诱导的肺水肿模型(Benametal.,2015b)。该系统的主要生物学方面是对细胞施加生理循环应变的应用,这不仅密切模仿正常的呼吸运动,而且影响细胞层的渗透性。体内研究表明,肺的膨胀和吸入一样,增加了肺对亲水分子的渗透性(Marksetal.,1985)。这可能是由于细胞间连接的拉伸,这增加了孔隙的大小,并允许更大的亲水分子通过连接(Masonetal.,2001)。开发用于其他类型上皮细胞培养的微流体系统的创新方法也可能适用于建立新的芯片肺系统。关于mps肺模型发展的进一步信息,请参阅最近的一篇综述(Nicholsetal.,2014)。尽管一致认为芯片上的肺系统是毒理学研究的有用工具,但很少有人使用这些系统进行毒理学研究。
北京佰司特贸易有限责任公司(https://www.best-sciences.com):
质量光度计-OneMP;类器官培养仪-HUMIMIC;灌流式细胞代谢分析仪-IMOLA;便携式4通道SPR仪-P4SPR;蓝光/绿光LED凝胶成像;Nanocellect细胞分选仪-WOLF;微纳加工点印仪-NLP2000/DPN50002021-10-02上一篇:前沿进展:通过微生理方法解决药物分子预测难题(二)-2
下一篇:没有了相关仪器 -
免责声明
①本网刊载上述内容,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任
②若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi

-
 认证会员 第
6 年
认证会员 第
6 年北京佰司特科技有限责任公司
认证:工商信息已核实
- 产品分类
- 品牌分类
-
仪企号
 北京佰司特贸易有限责任公司
北京佰司特贸易有限责任公司
-
友情链接
-
手机版开启全新的世界m.yiqi.com/zt71447/










