-
 过氧化氢 过氧化氢分解
过氧化氢 过氧化氢分解
 过氧化氢 过氧化氢分解
过氧化氢 过氧化氢分解
过氧化氢(双氧水)可以分解生成水和氧气,一般条件下,水不容易再分解。过氧化氢常温下即可分解,只是比较慢,但久置后会稀很多。此外,加入二氧化锰等等作催化剂能加快分解速度。
一、过氧化氢制取氧气改进实验
(一)实验装置的改进
1、改进后实验装置用20mL注射器将过氧化氢溶液加入250mL输液瓶中,将二氧化锰配置成悬浊液,用20mL注射器注入输液袋中,然后把输液瓶与输液袋用输液管连接起来,装置如下图所示。
2、实验仪器250mL输液瓶1个、输液袋、水槽、药匙、集气瓶、玻璃片、铁架台、20mL注射器2个、输液管1根。
(二)反应过程的改进
1、实验原理:过氧化氢在二氧化锰做催化剂的条件下分解生成氧气和水。
2、实验药品改进
(1)过氧化氢
①用20mL注射器将过氧化氢溶液加入250mL输液瓶中。
②过氧化氢溶液的浓度Z好是15%左右。
设计如下实验探究过氧化氢溶液浓度对分解速率的影响:在4支试管中分别加入0.5g二氧化锰,然后依次加入浓度是5%、10%、15%、20%的过氧化氢溶液各20ml,并记录收集50ml氧气所用的反应时间,数据如下表所示:
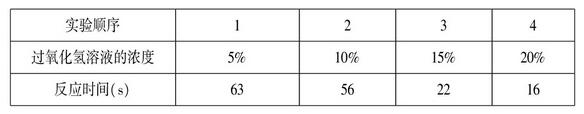
分析表中数据可知,过氧化氢溶液浓度低于15%,反应太慢,高于15%反应较快,并且反应速度基本稳定。所以,考虑反应速度的控制,过氧化氢溶液的浓度Z好是15%。
③加入15%过氧化氢溶液的量。我们设计了如下实验探究不同量的15%过氧化氢溶液收集的氧气量:在4支装有二氧化锰的试管中依次加入5ml、10ml、15ml、20ml的15%过氧化氢溶液,并记录下收集到的氧气量(用50ml集气瓶收集),数据如下表所示:
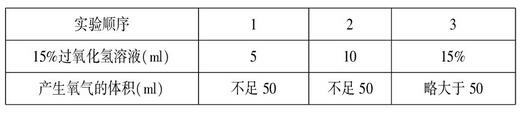
分析表中数据可知,大约15ml15%过氧化氢溶液可以收集50ml氧气。
(2)二氧化锰
①二氧化锰用量在0.4g-0.5g为宜。
设计如下实验探究二氧化锰的量对过氧化氢溶液分解速率的影响:在5支试管中分别加入0.1g、0.2g、0.3g、0.4g、0.5g二氧化锰,再依次加入15%过氧化氢溶液15ml,并记录收集50ml氧气所用的时间,数据如下表:

分析表中数据可知,二氧化锰质量大于0.4g以后,过氧化氢溶液分解速率就不变了,所以二氧化锰用量定在0.4g-0.5g。
②将二氧化锰配制成悬浊液用注射器加入输液袋中。
3、反应场所改进:打开输液瓶下方的开关让过氧化氢溶液进入输液袋中,与二氧化锰接触,在输液袋中反应。
4、实验步骤
①检查装置气密性。
②将过氧化氢溶液加入输液瓶中,将二氧化锰悬浊液用注射器注入输液袋中。
③打开输液瓶下端的止水夹和输液袋上的止水夹。
现象:水槽里面的水中有气泡冒出。
④用排水法收集氧气。
(三)改进后装置优点
1、安全性提高。本实验用到的医用输液瓶、输液袋、注射器、输液管都是塑料制品,不容易破碎,另外绝不用担心液体会飞溅出来,保证了实验的安全性。
2、节省药品。输液瓶里面的二氧化锰可以多次使用,损失的可能性也非常小;用过后拔掉输液管,里面的氧气不会扩散到空气中,下次使用可以减少过氧化氢的使用量。
3、密封性好。不论是输液瓶、输液袋还是输液管密封性能都很好,并且输液瓶和输液袋之间用输液管连接紧密,不会漏气。
4、反应易于控制。反应物过氧化氢与催化剂二氧化锰分开放置,连接他们的输液管上有开关,并且输液瓶上有刻度,可以根据制取氧气的量控制流入过氧化氢溶液的量,两个止水夹可以使反应随时发生随时停止。
5、操作简便。装置连接简单,装置气密性几乎不会出现问题,与实验室制取氧气的任何装置相比较,简便易操作。
6、降低实验成本,节约资金。输液瓶、输液袋和注射器都便宜很好找,可反复使用,尤其适合实验器材缺乏的农村学校。
7、适合学生做实验用,提高了实验成功率在实验前实验员只要取掉针头,分发到学生手中,讲清楚原理学生可提前组装,实验时只要按照操作步骤,一名学生就可完成,随即就可以进行氧气性质的验证。
8、此装置还可以制取氢气、二氧化碳等用固液不加热装置制取的气体。
二、过氧化氢分解速率影响因素
双氧水作为一种“绿色”试剂,广泛应用于化工、纺织、造纸、、电子、航天、医药、建筑及环境保护等行业。由于双氧水分子结构的低对称性及过氧键的存在,造成双氧水容易发生自分解反应。同时,高浓度双氧水溶液对杂质特别敏感,许多有机和无机杂质都会使其催化分解。因此,如何合理使用双氧水将是这类清洁试剂推广的主要因素。
(一)实验部分
1、主要试剂与仪器
实验所用试剂有KMnO4、Na2C2O2、CuSO4、MnSO4、ZnSO4、NaOH等均为分析纯,其中Na2C2O2需干燥后使用。
采用的仪器主要有DELTA 320 pH计。
2、溶液的标定
(1)高锰酸钾溶液的标定
用草酸钠为基准物来间接标定高锰酸钾溶液。准确称量0.07g草酸钠,取50mL水、5mL 3mol/L硫酸于100mL锥形瓶中,在75℃水浴条件下加热2min,使草酸钠完全溶解后开始滴加高锰酸钾溶液,直至溶液颜色变为粉红色时即为反应终点。
在酸性条件下,草酸钠与高锰酸钾的反应式为:
(2)双氧水溶液的标定
用标定后的高锰酸钾溶液作为基准物标定双氧水溶液。移取0.5mL双氧水于锥形瓶后依次加入50mL蒸馏水、10mL 3mol/L的硫酸,用标定后的高锰酸钾溶液标定双氧水,当溶度由无色变为粉红色时即为滴定终点。
在酸性条件下,高锰酸根与双氧水反应为:
3、温度对双氧水分解速率的影响
量取40mL双氧水于三颈瓶中,升温至40℃,保持温度且分别于0、5、10、20、30、40、50、70、90min时测定双氧水浓度。同理测定50℃,60℃温度下不同时间双氧水浓度。
4、pH对双氧水分解速率的影响
量取40mL双氧水于三颈瓶中,调节溶液pH=6.0后升温至60℃,保持温度且分别于0、20、40、60、80、100min时测定双氧水浓度。
同理测定pH=3.6、pH=4.5条件下不同时间双氧水浓度。
5、不同金属离子对双氧水的催化作用
在装有40mL双氧水的三颈瓶中加入一定浓度的Cu2+溶液后升温至60℃,保持温度且分别于0、20、40、50、60、80、100、120、140、160、180min时测定双氧水浓度。
同理测定不同浓度Mn2+,Zn2+的双氧水在相同条件不同时间下的浓度。
(二)结果与讨论
1、温度对双氧水分解速率的影响
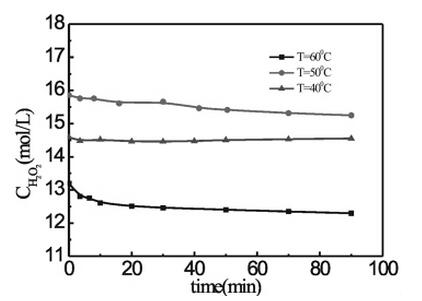
在相同条件下,反应速率常数k=α*exp(-Ea/RT),表明温度是影响化学反应速率的主要因素,即:速率常数k是一个与温度相关的函数。由下图可知,与40、50℃相比,60℃时双氧水的分解速率稍快,说明随着温度的增加双氧水的分解速率也随之增加,但是分解速率也较慢。总体来说,温度对双氧水的分解无较大影响。因此,若无其他催化条件的影响,双氧水在40℃以下能够保持稳定。
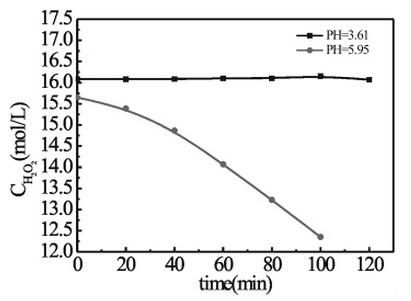
2、pH对双氧水分解速率的影响
由下图可知,pH=5.95时,双氧水的分解速率较快,而随着pH值的减小,双氧水的分解速率降低,当pH=3.61时双氧水分解速率接近零,表明当pH<3.5时,双氧水已经能够保持稳定。
3、金属离子对双氧水分解速率的影响
在实际生产中,金属离子引入反应体系中十分常见,如反应器本身或在储存、运输、生产过程中都可能带入金属离子,因此,研究几种常见的金属离子对双氧水分解速率的影响具有十分重要的意义。
①铜离子对双氧水分解速率的影响
由下图可知,加入铜离子后双氧水的分解速率明显加快,且浓度不同其催化能力也不同。铜离子浓度越大,双氧水的分解速率越快,即催化作用越强。
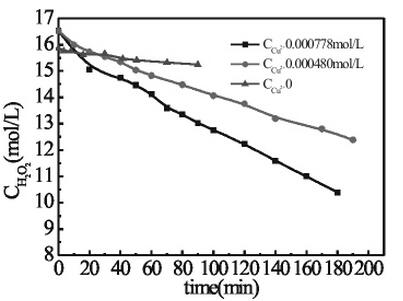
②锰离子对双氧水分解速率的影响
由下图可知,加入锰离子后双氧水的分解速率无明显变化,说明锰离子对双氧水的分解没有催化作用。
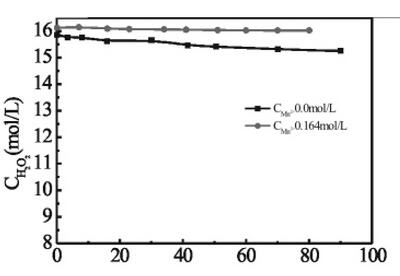
③锌离子对双氧水分解速率的影响
由下图可知,加入锌离子后双氧水的分解速率无明显变化,说明锌离子对双氧水的分解同样没有催化作用。

(三)结论
通过对双氧水在不同条件下分解速率的研究,得出3个方面的结论:
①随着温度的升高,双氧水的分解速率稍有加快,但总体来说分解速率仍较慢,因此双氧水在室温条件下较为稳定,可长久保存;
②双氧水在弱酸性和碱性条件下表现出不稳定性,快速分解,但是在PH<3.5的强酸性条件下双氧水是稳定的,因此,双氧水必须保持在酸性条件下,以维持其稳定性;
③铜离子对双氧水有明显的催化作用,能大大加快它的分解,而Mn2+、Zn2+对双氧水无明显的催化作用,因此双氧水要避免引入Cu2+,以维持双氧水的稳定性。
三、过氧化氢分解催化剂
在当下各行业大都是利用过氧化氢作为聚合物引发剂、氧化剂、交联剂和漂白剂等,作为绿色化工产品,新的应用领域不断出现。大量使用势必造成废水含有过氧化氢,这就要求必须把过氧化氢残留物清除,达到以减少废水中过氧化氢对生态环境的影响为目的。
解决的办法是寻找优良新型催化剂,催化分解从而除去过氧化氢。能使过氧化氢催化分解的物质很多,现今,用金属配合物作为模拟酶的研究方向是主流,在利用人工合成的化学品模拟过氧化氢酶这一过程中。
1、过氧化氢酶
过氧化氢酶作为一种氧化还原酶,普遍的于生物组织中存在,它的功能就是催化细胞内过氧化氢分解,防止膜脂过氧化进而可以保护细胞避免受体内代谢物的破坏,其作为一种催化转化能力Z高的酶,可以极高的速率催化分解过氧化氢为水和氧气,可以达到一分子过氧化氢酶每分钟能催化500万分子过氧化氢。
过氧化氢酶的区分类别是,一种真核过氧化氢酶和原核过氧化氢酶。真核过氧化氢酶主要来自植物和动物组织,包括哺乳动物组织中过氧化氢酶含量差异很大,肝脏含量Z高,Z低是结缔组织的含量,在组织细胞内过氧化氢酶主要存在于细胞器。微生物是原核过氧化氢酶的来源体。过氧化氢酶是存在于几乎所有的需氧微生物中,只有极少数的不存在过氧化氢酶,例如过氧化醋杆菌(A.peroxydas)。
根据他们的理化特性差异,可以将过氧化氢酶划分为典型性、非典型性和过氧化氢酶-过氧化物酶(catalase-peroxidases),通常认为这也是一种符合进化关系的划分。根据催化ZX结构差异可大致分为两类:
①含铁卟啉结构过氧化氢酶,又称铁卟啉酶;
②含锰离子替代铁的卟啉结构,又称为锰过氧化氢酶。
用过氧化氢来替代氯气这种含毒的漂白剂,用以工业漂白和消毒产品,这是从上世纪八十年代开始的,并且生产纸张和其他工业产品的工厂普遍开始使用过氧化氢作为有毒氯气的替代品来作为漂白和消毒产品。过氧化氢可以用来消除有害细菌在新鲜的蔬菜和水果,如大肠杆菌和沙门氏菌,还可用于消毒产品等。
在去除残留过氧化氢生产流程的过程中,人们逐渐把注意力转向酶的催化效率高,过氧化氢酶被大规模的使用在医药和食品、纺织等行业。过氧化氢酶酶制剂的应用会逐渐的普及并将逐步取代蛋白酶水解酶在纺织等行业的使用。
2、金属及金属氧化物
金属铂能作为过氧化氢催化分解物质。
有学者采用铂催化法分解过氧化氢。结果表明,铂催化法能在50℃以下分解破坏过氧化氢,催化速度与铂催化表面积成正比,同时不造成钚价态的变化,要控制他的分解速度方法就是依靠温度来控制,这种方法与加热分解法相比具有破坏速度平稳且钚价态不变等优点。采用铂催化分解法在常温就能使过氧化氢分解,分解速度和铂的催化表面积有着直接关系,其随温度增加而增加。
铁的氧化物具有高的催化分解过氧化氢活性。
有学者通过对过氧化氢催化分解反应动力学研究,通过这可以看出磁化合成铁氧体的催化效率有着很高的效果。并探讨了催化作用机理。考虑到反应物(过氧化氢)是反磁性,而生成物(氧气)是顺磁性,若无外部条件影响,涉及磁性的量子态不会自动变化,上述反应也不会自动发生;而某种磁状态的触发有可能影响该类反应。
3、金属配合物
金属配合物及其Schiff碱类化合物的应用已经得到广泛推广,并在医学和催化、分析化学等各个领域使用及推广。利用Schiff碱具有的YJ和杀菌、抗肿瘤、YZ病毒的生物活性广泛使用在医学领域;催化领域Schiff碱中的钴和镍也是一种催化剂,不过是作为配合物来使用;Schiff碱也可以是一种铜的缓蚀剂被利用在腐蚀领域;同时,Shciff碱利用其特性基因在光致变色领域中也有很好的使用方式。
Schiff碱作催化剂主要应用于聚合反应、不对称催化环丙烷化反应以及烯烃催化氧化方面和电催化领域。另外,Z近研究表明,有些含O、N的Schiff碱金属配合物还具有仿酶催化活性。Schiff碱的过渡金属配合物(其中配合物所选的金属离子主要为Cu(II)、Mn(II)、Co(II)等离子)在各个专业领域得到广泛的应用,尤其是医药领域以及生命领域内都具有极为广泛的应用范围。
有学者制备出6种具有催化效果的希夫碱金属配合物,并研究分析了希夫碱金属配合物对过氧化氢分解的催化作用并将其应用于棉织物等浸渍漂白等工艺,考察其催化效果。
实验表明,在没有催化剂的情况下,过氧化氢条件下的低温和低碱分解速率非常缓慢,远低于要求的漂白。添加催化剂,双氧水分解率有了明显的提高,这就解释了希夫碱金属配合物具有良好的催化分解过氧化氢的影响。
催化剂的催化效果有着明显的差别,即使是在同样的外部条件下进行,不过总体来说催化剂的催化效果为铜配合物好于钴配合物,钴配合物好于锰配合物,同时他也考查了特定稳定剂加配合物催化剂改进的氧漂汽蒸工艺对织物损伤较小,具有一定节能减排的优势。
有学者也合成了如:乙酰胺合铜、二丙酮缩乙二胺合铜,乙二胺合铜等新型配合物、其中乙二胺合铜还培养出来了单晶,并考察了不同条件下催化剂对双氧水分解的影响,实验表明催化活性都非常,并能多次重复使用。
4、杂多酸及其盐
有学者通过实验发现,十二钼磷酸对H2O2分解几乎无活性,而其盐类(Fe3+、Cu2+、Co2+、Mn2+)则都有很好的活性,认为活性种是杂多酸盐的抗衡阳离子。如在杂多酸阴离子中引入V,部份的取代钼,不仅催化剂活性随V的取代数有规律地增加,而且,动力学曲线具有S-型特征,表明反应中活性ZX-阴离子中的钒和底物作用生成活性中间体。
5、复合体系催化剂
两种及两种以上物质组成,其中至少一种具有催化活性,另一种具有促进作用,这样的催化剂叫复合体系催化剂。陈小斌等研究发现碘化钾和钨酸钠一定比例混合物有着强烈的催化分解作用,其作用条件是在碱性条件下进行,这些复合体系对过氧化氢的催化分解有着明显的共同促进效果。分析出了催化剂对催化双氧水分解速度的影响。
当碘化钾与钨酸钠物质的量比为5:5~6:4时,催化活性Z高。给出了催化反应的动力学方程,计算得到反应的Arrhenius活化能Ea=24.4KJ·mol·L-1,并对催化反应机理进行了合理的推测。
①本文由仪器网入驻的作者或注册的会员撰写并发布,观点仅代表作者本人,不代表仪器网立场。若内容侵犯到您的合法权益,请及时告诉,我们立即通知作者,并马上删除。
②凡本网注明"来源:仪器网"的所有作品,版权均属于仪器网,转载时须经本网同意,并请注明仪器网(www.yiqi.com)。
③本网转载并注明来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
④若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi