-
 色谱 离子交换色谱
色谱 离子交换色谱
 色谱 离子交换色谱
色谱 离子交换色谱
离子交换色谱是利用离子交换原理和液相色谱技术的结合来测定溶液中阳离子和阴离子的一种分离分析方法。凡在溶液中能够电离的物质通常都可以用离子交换色谱法进行分离。离子交换色谱技术常被用于蛋白质、寡核苷酸、多肽、病毒、噬菌体、多糖等的纯化。
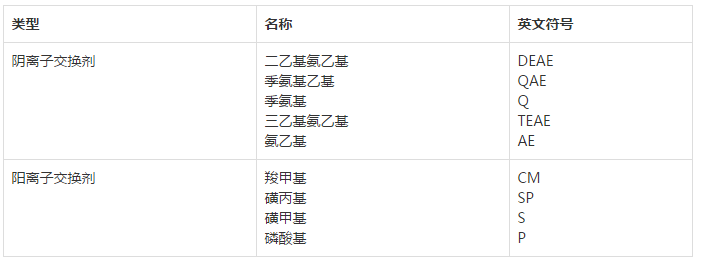
离子交换色谱是将离子交换基因(CM、SP、Q、DEAE等)键合于一定的惰性载体(纤维素、交联葡聚糖,交联琼脂糖等)之上,并以此作为固定相,依据样品所带电荷的不同,从而与固定相上的离子交换基团相互作用的程度不同而进行分离的一种色谱方法。
离子交换剂是在载体上键合了一些离子交换基团,而离子交换基团在水溶液中通过电离释放出游离的离子,这些离子可带正电或带负电,可以被溶液中的其它带相同电荷的离子取代,并对离子交换剂有较强的结合力。结合力的大小不仅受离子与离子交换剂之间作用力的影响,而且主要受离子浓度的影响,这个过程中的作用力是静电引力,离子交换的原理是静电相互作用。
以蛋白质分离纯化为例:由于蛋白质有等电点,当蛋白质处于不同的pH条件下,其带电状况也不同。阴离子交换基质结合带有负电荷的蛋白质,所以这类蛋白质被留在柱子上,然后通过提高洗脱液中的盐浓度等措施,将吸附在柱子上的蛋白质洗脱下来,结合较弱的蛋白质首先被洗脱下来,从而达到分离提纯的作用。
蛋白质在离子交换色谱上的保留时间取决于蛋白质在相应色谱条件下所带静电荷的多少,而蛋白质所带静电荷的多少是由蛋白质分子的pI和所处溶液环境的pH共同决定的。在酸性条件下,蛋白质带正电荷;在碱性条件下,蛋白质带负电荷。在阳离子交换柱上,只有pI大于流动相pH的蛋白质在柱子上保留,而pI小于或等于流动相pH的蛋白质不保留,即使它们的pI值彼此之间有差异,也都作为溶剂峰同时被直接冲洗出来。而被保留的蛋白质出峰顺序则是pI小的先出峰,pI大的后出峰。在阴离子交换柱上情况则恰恰相反。
绝大多数重组蛋白纯化都要用到离子交换。离子交换色谱的基础是高分辨率,可以直接放大规模应用在工业上,柱再生容易,还可以使蛋白浓缩。大多数蛋白质的静电荷是负值,因此阴离子交换色谱的应用Z为广泛。
介质的选择
离子交换介质首先要考虑目的分子的大小,因为目的分子会影响其接近介质上的带电功能集团,因此也会影响介质对目的分子的动力载量,从而影响其分离。
对于大多数纯化步骤来说,建议从开始的阶段使用强离子交换柱,可在摸索方法的过程中有一个宽的pH范围。对于已知等电点的蛋白质,可根据其等电点来选择。而未知等电点的蛋白质,在实际操作中常采用这样的方法,先选择一个阴离子交换剂,再选择一个中性的pH缓冲液,将蛋白质样品透析至pH7.0,然后过阴离子交换柱。根据过柱后的结果确定下一个使用的缓冲液pH。
流动相的选择
离子交换色谱的流动相必需是有一定离子强度的并对pH有一定缓冲能力的溶液。为了避免目的蛋白失活,使用缓冲液可稳定流动相的pH,使之在色谱过程中不发生明显变化,同时可稳定目的分子上的电荷量,保证色谱结果的重要性。
选择缓冲液一般按照以下原则:阳离子交换剂应选用阴离子缓冲液,可用柠檬酸盐、磷酸盐、醋酸盐、甘氨酸盐等;阴离子交换剂应选用阳离子缓冲液,可用烷基胺、Tris、氨基乙醇胺、乙二胺、咪唑等;起始缓冲液的浓度应尽可能低(<100mmol/L)这样可以使色谱柱上更多的吸附分离物质;缓冲液应不含会影响被分离物质活性和溶解度成分,洗脱时尽量不采用pH梯度洗脱。
色谱柱的选择
离子交换色谱通常选用粗短柱,即高径比小的色谱柱。典型的离子交换柱高度在5~20cm,高径比一般小于5。如果需要增加离子交换剂的体积,只能从增加柱的直径而不能增加其高度。如果是连续梯度洗脱,可以适当增加柱的长度。
a. 样品的预处理
b. 样品的平衡
将实验一中50%饱水硫酸铵沉淀、离心得到的上清液,置于透析袋中,于20~40倍体积的pH8.5 20 mmol/L Tris-HCl,1 mmol/L EDTA的缓冲液中,4℃搅拌透析24 h,中间换透析液3~4次,4℃ 12 000 rpm离心15 min,收集上清,测定蛋白浓度,记录体积。
c. 阴离子柱Q-Sepharose FF的平衡及上样
取阴离子交换基质Q-Sepharose FF装柱,柱体积5.4×20 cm用pH8.5 20 mmol/L Tris-HCl 1 mmol/L EDTA 缓冲液流洗平衡层析柱,调整好蛋白检测仪的量程及记录仪灵敏度。将收集的上清液以8 ml/min流速上样。平衡缓液冲直至流出液吸光值恢复至基线。收集穿过峰,量体积,测蛋白含量。
d. 洗脱
洗脱液A为pH8.5 20 mmol/L Tris-HCl,1 mmol/L EDTA缓冲液,洗脱液B为含终浓度为1 mol/L NaCl的A液进行线性梯度洗脱(根据纯化条件设定的纯化工艺),收集各洗脱峰量体积,测蛋白浓度,进行SDS-PAGE或进行活性鉴定TNF所在峰。
e 将活性峰用pH7.5 20 mmol/L PB透析24 h,中间换液3次。离心,取上清并量其体积,测蛋白浓度。
f. 阳离子柱SP-Sepharose FF的平衡及上样
取阳离子交换基质SP-Sepharose FF装柱,柱体积2.5×10 cm,用pH7.5 20 mmol/L PB缓冲液流洗平衡层析柱,调整好蛋白检测仪的量程及记录仪的灵敏度,将透析、离心后的TNF的峰液以4 ml/min的流速上样,用平衡液洗至基线,收集穿过峰,量体积,测蛋白浓度。
g. 洗脱
阳离子层析柱SP-Sepharose FF的洗脱液A为pH7.5 20 mmol/L PB,洗脱液B为含1 mol/L NaCl的A液进行线性梯度洗脱,收集各洗脱峰,量体积,测蛋白质浓度,进行SDS-PAGE或活性鉴定。
h. 后处理
进行TNF的纯度、活性等鉴定,按要求分装加赋形剂冷冻干燥后制成一定效价的TNF产品。
①本文由仪器网入驻的作者或注册的会员撰写并发布,观点仅代表作者本人,不代表仪器网立场。若内容侵犯到您的合法权益,请及时告诉,我们立即通知作者,并马上删除。
②凡本网注明"来源:仪器网"的所有作品,版权均属于仪器网,转载时须经本网同意,并请注明仪器网(www.yiqi.com)。
③本网转载并注明来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
④若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi