-
 金属 金属及其化合物
金属 金属及其化合物
 金属 金属及其化合物
金属 金属及其化合物
金属是一种具有光泽(即对可见光强烈反射)、富有延展性、容易导电、导热等性质的物质。金属在自然界中广泛存在,在生活中应用极为普遍,是在现代工业中非常重要和应用Z多的一类物质。
金属化合物,是指合金中的两个元素,按一定的原子数量之比相互化合,而形成的具有与这两元素完全不同类型晶格的化合物。金属化合物晶格一般比较复杂。通常它们具有高的硬度、熔点和脆性,因此,不能直接使用。金属化合物在合金中一般起强化作用。
1、钠及其化合物之间的转化:
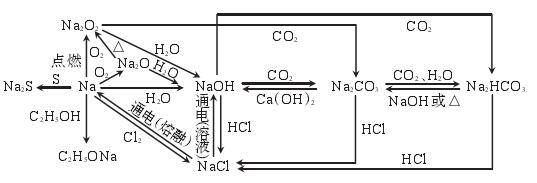
2、钠与水、酸反应的实质都是与H+的反应。
注意:钠也可与乙醇反应生成氢气,但较与水反应缓和。
3、金属钠与可溶性盐溶液反应的思维模板:
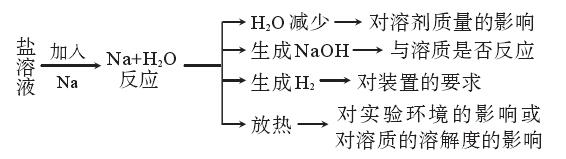
注意:钠与熔融的盐反应才能置换出盐中的金属。
4、从“四个角度”理解Na2O2与H2O、CO2反应的定量关系。
(1)物质的量的关系。
无论是CO2或H2O的单一物质还是二者的混合物,通过足量的Na2O2时,CO2或H2O与放出O2的物质的量之比均为2∶1。
(2)气体体积关系。
若CO2和水蒸气的混合气体(或单一气体)通过足量的Na2O2,则气体体积减小的量等于原混合气体体积的1/2,且等于生成氧气的体积。
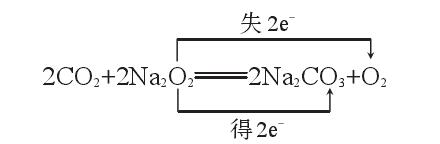
(3)转移电子关系。
2molNa2O2不论与H2O反应还是与CO2反应,均生成1molO2、转移2mol电子。例如:
(4)固体质量关系(质量守恒定律的拓展应用)。
由化学方程式的生成物中固体(NaOH或Na2CO3)与反应物中固体(Na2O2)的化学式及式量比较可知,每1molCO2或水蒸气与足量Na2O2反应时,固体增重28g或2g,从组成上看相当于吸收了CO2中的“CO”,或水蒸气中的“H2”,所以固体增加的质量Δm=28n(CO2)或Δm=2n(H2O)。
此规律适用于通式符合(CO)m(H2)n的纯净物或混合物,在O2中充分燃烧后产物被足量Na2O2吸收后固体质量增重问题的解决。如wg符合通式为(CO)m(H2)n的物质,在O2中充分燃烧后,将其产物通过足量的Na2O2固体,反应完毕,固体增重也必是wg。常见物质中符合通式的有CO、H2、CH3OH(甲醇)、C6H12O6(葡萄糖)等。
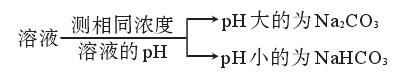
5、Na2CO3和NaHCO3的鉴别。
(1)热稳定性不同:

(2)和酸反应生成气体的速率不同(相同条件下):

(3)溶液的酸碱性不同:
6、碱金属元素简介。
(1)碱金属随着原子序数的递增,与O2反应越来越剧烈,产物越来越复杂。锂与O2反应只生成Li2O,钠与O2反应生成Na2O、Na2O2,钾、铷、铯与O2反应还能生成更复杂的氧化物。
(2)碱金属的密度一般随着核电荷数的增大而增大,但钾的密度比钠的小。
(3)碱金属一般都保存在煤油中,但由于锂的密度小于煤油的密度而将锂保存在石蜡中。
7、焰色反应。
(1)焰色反应的概念:某些金属或它们的化合物在灼烧时都会使火焰呈现出特殊的颜色。焰色反应属于物理变化。
(2)焰色反应的操作:
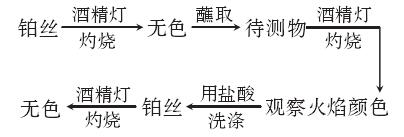
(3)常见元素的焰色:钠元素呈现黄色;钾元素呈现紫色(透过蓝色钴玻璃观察);铜元素呈现绿色。
1、镁及其化合物之间的转化:
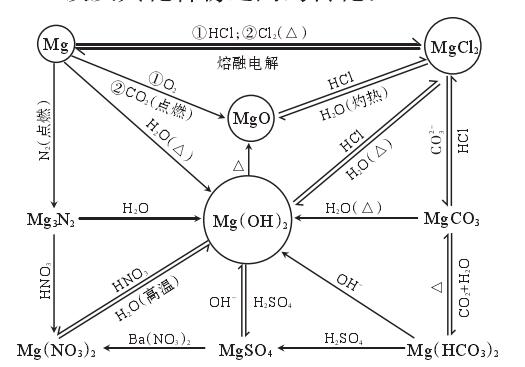
2、镁在空气中燃烧除生成MgO外,还发生反应:3Mg+N2→Mg3N2,2Mg+CO2→2MgO+C。
注意:Mg在CO2中能够燃烧,所以金属镁着火时不能用干冰灭火器和泡沫灭火器进行灭火。
3、镁可与沸水反应生成中强碱氢氧化镁,氧化镁为碱性氧化物,不能与氢氧化钠反应。
4、Mg、MgO、Mg(OH)2与NH4Cl溶液的反应。
(1)Mg、MgO都能和NH4Cl溶液反应,原理是NH4++H2O↔NH3·H2O+H+,Mg、MgO与H+反应,平衡向右移动。如Mg+2NH4Cl→MgCl2+2NH3↑+H2↑。
(2)Mg(OH)2溶于NH4Cl溶液,原理为:Mg(OH)2(s)↔Mg2+(aq)+2OH-(aq),NH4+与OH-结合成NH3·H2O,使沉淀溶解平衡向右移动。
1、铝及其化合物之间的转化:
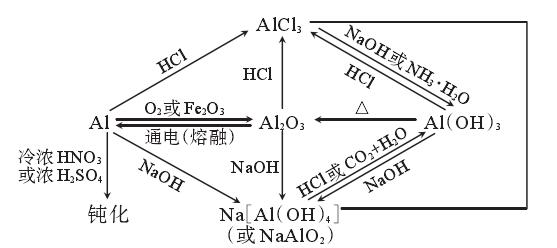
2、金属铝的特殊化学性质。
(1)活泼金属与酸反应是金属的通性,而铝不但能与非氧化性酸(H+)反应产生H2,还能与强碱反应产生H2,这一特殊性质常作为推断题的“题眼”。
(2)铝和某些金属氧化物反应,将其从氧化物中置换出来,同时放出大量的热的反应称为铝热反应。铝热反应可用于焊接金属、冶炼高熔点贵重金属。
(3)铝虽然是活泼金属,却有极强的耐腐蚀性。原因是铝与氧气反应后生成了致密的氧化膜,阻止了反应的继续进行。铝在常温下,在浓硝酸或浓硫酸中也会形成致密的氧化膜,这种现象被称为钝化,因此,可以用铝来运输和存储浓硝酸与浓硫酸。
注意:(1)Al在酒精灯火焰上加热至熔化,熔化的Al不滴落,原因是Al2O3的熔点高于Al。(2)与铝粉反应放出H2的溶液可能是酸性溶液(不能是硝酸),也有可能是碱性溶液。(3)Al并不是与所有金属氧化物均能组成铝热剂,铝热剂中的金属氧化物对应的金属活泼性应比Al弱。如CuO与Al能发生铝热反应,而Al与MgO不能发生铝热反应。
3、含Al3+的溶液与碱反应的先后顺序。
当溶液中有多种离子时,要考虑离子之间的反应顺序,如向含有H+、NH4+、Mg2+、Al3+的混合溶液中逐滴加入NaOH溶液,NaOH先与H+反应,再与Mg2+、Al3+反应生成沉淀,然后与NH4+反应,Z后才溶解Al(OH)3沉淀。
4、可溶性铝盐与强碱反应的计算规律。
(1)求产物Al(OH)3的量。
①当n(OH-)≤3n(Al3+)时:n[Al(OH)3]=⅓n(OH-);
②当3n(Al3+)<n(OH-)<4n(Al3+)时:n[Al(OH)3]=4n(Al3+)-n(OH-);
③当n(OH-)≥4n(Al3+)时:n[Al(OH)3]=0,无沉淀。
(2)求反应物碱的量。
①当碱不足(Al3+未完全沉淀)时:n(OH-)=3n[Al(OH)3];
②当碱使生成的Al(OH)3部分溶解时:n(OH-)=4n(Al3+)-n[Al(OH)3]。
1、铁及其化合物之间的转化。
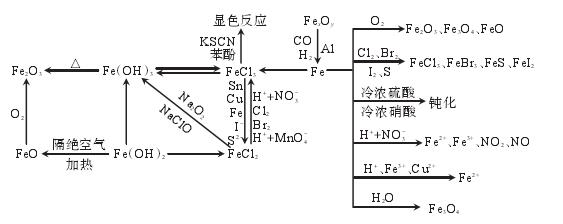
2、“铁三角”的转化关系。
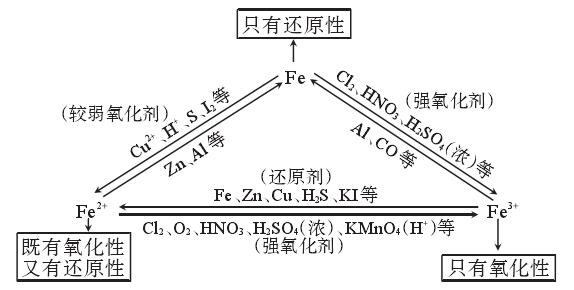
注意:(1)铁元素是变价金属元素,有+2、+3等多种价态,它与氧化性不同的氧化剂反应时,产物中铁元素的化合价不同:①Fe被弱氧化剂,如S、I2、H+、Fe3+、Cu2+等,氧化为Fe2+;②Fe被强氧化剂,如Cl2、Br2、HNO3、浓H2SO4(△)等,氧化为Fe3+(在溶液中反应,若铁过量还有可能生成Fe2+)。
(2)许多题目将Fe+2Fe3+→3Fe2+设置为隐含反应,如Fe与Fe2O3的混合物溶于盐酸时,生成的Fe3+还能氧化单质铁。
(3)FeCl3、FeCl2和Fe(OH)3都可以通过化合反应制取:2Fe+3Cl2→2FeCl3,2FeCl3+Fe→3FeCl2,4Fe(OH)2+O2+2H2O→4Fe(OH)3。
3、Fe2+和Fe3+的检验。
(1)直接观察颜色:Fe2+的溶液呈浅绿色,Fe3+的溶液呈棕黄色。
(2)显色反应:

有关离子反应方程式:Fe3++3SCN-→Fe(SCN)3。
(3)其化合物沉淀的颜色:
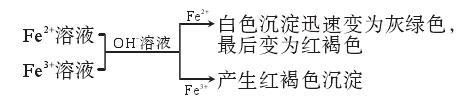
有关反应的方程式:Fe2++2OH-→Fe(OH)2↓,4Fe(OH)2+2H2O+O2→4Fe(OH)3,Fe3++3OH-→Fe(OH)3↓。
4、成功制备Fe(OH)2的关键。
由于Fe(OH)2具有很强的还原性,易被氧化为Fe(OH)3,在实验室中制备Fe(OH)2,并使Fe(OH)2长时间保持白色沉淀状态,成为物质制备实验探究的热点。
(1)制备原理:Fe2++2OH-→Fe(OH)2↓。
(2)成功关键:①溶液中不含Fe3+和O2等氧化性物质;②制备过程中,保证生成的Fe(OH)2在密闭的隔绝空气的体系中。
5、Fe(OH)3胶体的制备。
向沸腾的蒸馏水中逐滴加入1~2mL饱和FeCl3溶液,继续煮沸至液体呈红褐色,停止加热。反应的化学方程式:FeCl3+3H2O→Fe(OH)3(胶体)+3HCl。
1、铜及其化合物之间的转化网络图。
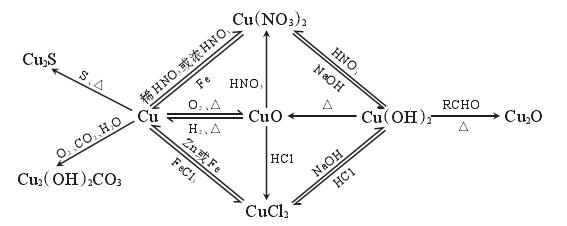
2、铜在潮湿的空气中Z终生成的不是CuO,而是Cu2(OH)2CO3。
3、新制Cu(OH)2悬浊液常用来检验醛基的存在。
4、无水CuSO4粉末常用作水的检验试剂。向CuSO4溶液中逐滴加入氨水,首先生成蓝色沉淀,继续滴加氨水,沉淀溶解,形成深蓝色透明溶液。
注意:Zn(OH)2、Cu(OH)2、AgOH能溶于氨水。
5、足量Cu和一定量的浓HNO3反应,随着反应的进行,硝酸由浓变稀,生成的是NO2和NO的混合气体。由于Cu有剩余,再加入稀H2SO4,Cu会继续溶解。
6、铜及其化合物的颜色。
Cu——紫红色,
CuO——黑色,
Cu2O——砖红色,
Cu2S——黑色,
CuSO4——白色,
CuSO4·5H2O——蓝色,
Cu2(OH)2CO3——绿色,
Cu(OH)2——蓝色。
1、金属在自然界中存在的形态。
除了金、铂等极少数金属外,绝大多数金属以化合物的形式存在于自然界中。在这些金属化合物中,金属元素都显正价。
2、金属冶炼的实质。
金属的冶炼是使金属化合物中的金属离子得电子,被还原为金属单质的过程:Mn++ne-→M。
3、金属冶炼的一般步骤。

4、金属的冶炼方法。
(1)电解法。
例如:电解Al2O3、MgCl2、NaCl,其化学方程式依次为:2Al2O3(熔融)→4Al+3O2↑,MgCl2(熔融)→Mg+Cl2↑,2NaCl(熔融)→2Na+Cl2↑。
(2)热还原法。
①焦炭还原法。例如:C还原ZnO、CuO,其化学方程式依次为:C+2ZnO→2Zn+CO2↑,C+2CuO→2Cu+CO2↑。
②一氧化碳还原法。例如:CO还原Fe2O3、CuO,其化学方程式依次为:3CO+Fe2O3→2Fe+3CO2,CO+CuO→Cu+CO2。
③氢气还原法。例如:H2还原WO3、Fe3O4,其化学方程式依次为:3H2+WO3→W+3H2O,4H2+Fe3O4→3Fe+4H2O。
④活泼金属还原法。例如:Al还原Cr2O3、V2O5,其化学方程式依次为:2Al+Cr2O3→Al2O3+2Cr,10Al+3V2O5→6V+l2O3。
(3)热分解法。例如:2HgO→2Hg+O2↑,2Ag2O→4Ag+O2↑。用热分解法冶炼金属的特点:金属元素的金属性弱,金属元素的原子不易失去电子,其金属离子容易得到电子,该金属元素所形成的化合物稳定性较差。
注意:(1)不能用电解AlCl3和MgO的方法冶炼Al和Mg,因为AlCl3是共价化合物,熔融时无法电离出自由移动的离子,不导电;而MgO虽是离子化合物,但其熔点太高,熔融会消耗大量的电能,成本较高。
(2)选择金属冶炼的方法时要依据金属在自然界中的存在形态和金属的活动性。金属活动性顺序表中,金属的位置越靠后,越容易被还原;金属的位置越靠前,越难被还原。例如:铝的金属活动性比铁、铜强,难于冶炼,古代人们的技术条件达不到,无法冶炼铝,故铝的发现和大量使用比铁和铜晚得多。
(3)化学性质很稳定的金属,如Au、Pt等,在自然界中呈游离态,用物理方法即可得到。
(4)有些活动性很强的金属也可以用还原法来冶炼,例如:Na+KCl→K↑+NaCl,2RbCl+Mg→MgCl2+2Rb↑等,其主要运用了化学平衡移动原理,K、Rb的沸点低,汽化后便会离开反应体系,使化学反应得以向正反应方向进行。
①本文由仪器网入驻的作者或注册的会员撰写并发布,观点仅代表作者本人,不代表仪器网立场。若内容侵犯到您的合法权益,请及时告诉,我们立即通知作者,并马上删除。
②凡本网注明"来源:仪器网"的所有作品,版权均属于仪器网,转载时须经本网同意,并请注明仪器网(www.yiqi.com)。
③本网转载并注明来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
④若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi